题目内容
2.莫尔盐,简称FAS,蓝绿色的无机复盐,在空气中逐渐风化及氧化,其名来源于德国化学家莫尔(Karl Friedrich Mohr).工业常用的制备方法是从废铁屑中回收铁屑(不含铁之外的其他金属元素),经碱溶液洗净之后,用过量硫酸溶解;再加入稍过量硫酸铵饱和溶液,在小火下蒸发溶剂直到晶膜出现,停火利用余热蒸发溶剂;过滤后用少量乙醇洗涤.莫尔盐的化学式可能是( )| A. | NH4Fe(SO4)2•12H2O | B. | NH4Al(SO4)2•12H2O | C. | (NH4)2Fe(SO4)2•6H2O | D. | (NH4)2Fe(SO4)2 |
分析 莫尔盐,简称FAS,蓝绿色的无机复盐在空气中逐渐风化及氧化,工业常用的制备方法是从废铁屑中回收铁屑(不含铁之外的其他金属元素),经碱溶液洗净之后,用过量硫酸溶解;再加入稍过量硫酸铵饱和溶液,在小火下蒸发溶剂直到晶膜出现,停火利用余热蒸发溶剂;过滤后用少量乙醇洗涤,莫尔盐中含铁元素,存在的离子为亚铁离子,含有铵根离子、硫酸根离子,析出晶体带有结晶水,据此分析判断;
解答 解:莫尔盐,简称FAS,蓝绿色的无机复盐在空气中逐渐风化及氧化,工业常用的制备方法是从废铁屑中回收铁屑(不含铁之外的其他金属元素),经碱溶液洗净之后,用过量硫酸溶解;再加入稍过量硫酸铵饱和溶液,在小火下蒸发溶剂直到晶膜出现,停火利用余热蒸发溶剂;过滤后用少量乙醇洗涤,莫尔盐中含铁元素,存在的离子为亚铁离子,含有铵根离子、硫酸根离子,析出晶体带有结晶水,
A.化学式中铁元素为+3价,故A不符合;
B.化学式中无铁元素,故B不符合;
C.(NH4)2Fe(SO4)2•6H2O化学式中离子符号,带有结晶水,是莫尔盐的化学式,故C正确;
D.化学式中无结晶水,故D不符合;
故选C.
点评 本题考查了物质组成、结构、性质的分析判断,注意题干信息的分析应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| B. | 0.5mol C3H8分子中所含C-H共价键数为2NA | |
| C. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| D. | 1mol碳正离子CH5+所含的电子数为11NA |
13.已知:HBF4、Pb(BF4)2均是易溶于水的强电解质.铅-二氧化铅-氟硼酸(HBF4)电池是一种低温性能优良的电池,常用于军事和国防工业,其总反应方程式为:Pb+PbO2+4HBF4$?_{充电}^{放电}$2Pb(BF4)2+2H2O,下列说法中正确的是( )
| A. | 放电时,负极质量增加 | |
| B. | 放电时,溶液中的BF4-只向正极移动 | |
| C. | 充电时,阳极附近溶液的酸性增强 | |
| D. | 充电时,阴极的电极反应式为Pb2+-2e-=Pb |
10.很多有机反应都会受反应条件的影响,同样的反应物,如果反应条件不同,其生成物可能截然不同,下列各项中不能体现这一观点的是( )
| 反应物 | 反应条件1 | 反应条件2 | |
| A | CH3CHICH3 | NaOH的水溶液,加热 | NaOH的乙醇溶液,加热 |
| B | 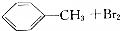 | 光照 | 铁粉 |
| C | 乙醇+氧 | 点燃 | Cu做催化剂,加热 |
| D | 乙烯 | 溴水 | 溴的四氯化碳溶液 |
| A. | A | B. | B | C. | C | D. | D |
17.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 34g质量分数为4%的H2O2水溶液中含氧原子数目为0.08NA | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92kJ/mol,若放出热量4.6kJ,则转移电子数目为0.3NA | |
| C. | 0.1mol•L-1Na2S溶液中所含S2-总数小于0.1NA | |
| D. | 6.4gCu与40mL10mol•L-1浓硝酸作用能生成NO2的分子数为0.2NA |
7.下列离子或分子在溶液中能大量共存,加入盐酸后因发生氧化还原反应而不能大量共存的一组是( )
| A. | K+、Na+、SO42-、Cl2 | B. | Ca2+、Na+、Br-、CO32- | ||
| C. | Na+、Fe2+、Cl-、NO3- | D. | K+、Ag+、NH3•H2O、NO3- |
1.二氧化碳与氢气催化合成甲醇,发生的反应为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-46kJ•mol-1
(1)甲醇可与钠反应,写出反应的化学方程式:2CH3OH+2Na→2CH3ONa+H2↑.
(2)已知H-H、C-O、C═0、H-O键的键能依次为436kJ•mol-1、326kJ•mol-1、803kJ•mol-1、464kJ•mol-1,则C-H键的键能为414kJ•mol-1.
(3)一定条件下,将n(CO2):n(H2)=1:1的混合气充入绝热恒容密闭容器中发生反应,下列事实可以说明该反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)已达到平衡的是BCD(填字母)
A、容器内气体密度保持不变 B、CO2的体积分数保持不变
C、该反应的平衡常数保持不变 D、混合气体的平均相对分子质量不变
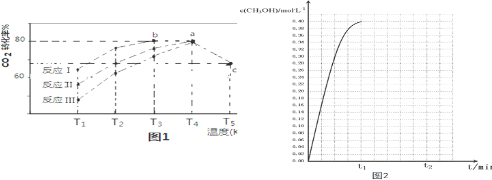
(4)一定条件下,往2L恒容密闭容器中充入1.2molCO2和3.6molH2,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g).在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,在相同时间内CO2转化率随温度变化的数据如表所示,根据表中数据绘制如图(T5时,图中c点转化率为66.67%,即转化了$\frac{2}{3}$):
①催化剂效果最佳的反应是Ⅰ(填“Ⅰ”、“Ⅱ”、“Ⅲ”)
②T3的b点v(正)=v(逆).(填“>”“<”“=”)
③T4的a点转化率比T5的c点高原因是T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低..
④在温度为T5时,该反应的平衡常数K=3.70.
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-46kJ•mol-1
(1)甲醇可与钠反应,写出反应的化学方程式:2CH3OH+2Na→2CH3ONa+H2↑.
(2)已知H-H、C-O、C═0、H-O键的键能依次为436kJ•mol-1、326kJ•mol-1、803kJ•mol-1、464kJ•mol-1,则C-H键的键能为414kJ•mol-1.
(3)一定条件下,将n(CO2):n(H2)=1:1的混合气充入绝热恒容密闭容器中发生反应,下列事实可以说明该反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)已达到平衡的是BCD(填字母)
A、容器内气体密度保持不变 B、CO2的体积分数保持不变
C、该反应的平衡常数保持不变 D、混合气体的平均相对分子质量不变
(4)一定条件下,往2L恒容密闭容器中充入1.2molCO2和3.6molH2,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g).在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,在相同时间内CO2转化率随温度变化的数据如表所示,根据表中数据绘制如图(T5时,图中c点转化率为66.67%,即转化了$\frac{2}{3}$):
| 相同时间内CO2转化率 | T1 | T2 | T3 | T4 | T5 |
| 反应Ⅰ | 65% | 77% | 80% | 80% | 66.67% |
| 反应Ⅱ | 56% | 67% | 76% | 80% | 66.67% |
| 反应Ⅲ | 48% | 62% | 72% | 80% | 66.67% |
②T3的b点v(正)=v(逆).(填“>”“<”“=”)
③T4的a点转化率比T5的c点高原因是T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低..
④在温度为T5时,该反应的平衡常数K=3.70.

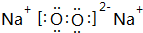 ;属于离子化合物(填“离子”或“共价”);
;属于离子化合物(填“离子”或“共价”); ;属于共价化合物(填“离子”或“共价”);
;属于共价化合物(填“离子”或“共价”);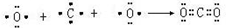 ;
;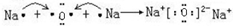 .
.