题目内容
10.一块碳素钢表面有一层薄薄的水膜,若这层水膜酸性很弱或显中性,则发生吸氧腐蚀,其正极反应式为O2+4e-+2H2O=4OH-,电池总反应式为2Fe+O2++2H2O=2Fe(OH)2;若钢铁表面的水膜呈酸性,则此时钢铁发生析氢腐蚀,负极的电极反应式为Fe-2e-=Fe2+,电池总反应式为Fe+2H+=Fe2++H2↑.分析 钢铁的电化学腐蚀分为析氢腐蚀和吸氧腐蚀,当水膜呈酸性时,发生析氢腐蚀,当水膜呈中性或弱酸性时,发生吸氧腐蚀,据此分析.
解答 解:钢铁的电化学腐蚀分为析氢腐蚀和吸氧腐蚀,当水膜呈中性或弱酸性时,发生吸氧腐蚀,负极上铁失电子放电:Fe-2e-=Fe2+,正极上氧气放电:O2+4e-+2H2O=4OH-,总反应为:2Fe+O2++2H2O=2Fe(OH)2;当水膜呈酸性时,发生析氢腐蚀,负极上铁失电子放电:Fe-2e-=Fe2+,正极上氢离子放电:2H++2e-=H2↑,总反应为:Fe+2H+=Fe2++H2↑,
故答案为:吸氧;O2+4e-+2H2O=4OH-;2Fe+O2++2H2O=2Fe(OH)2;析氢;Fe-2e-=Fe2+;Fe+2H+=Fe2++H2↑.
点评 本题考查了钢铁的析氢腐蚀和吸氧腐蚀的正负极反应和总反应,应注意的是水膜的酸碱性对腐蚀类型的影响.

练习册系列答案
相关题目
13.已知:HBF4、Pb(BF4)2均是易溶于水的强电解质.铅-二氧化铅-氟硼酸(HBF4)电池是一种低温性能优良的电池,常用于军事和国防工业,其总反应方程式为:Pb+PbO2+4HBF4$?_{充电}^{放电}$2Pb(BF4)2+2H2O,下列说法中正确的是( )
| A. | 放电时,负极质量增加 | |
| B. | 放电时,溶液中的BF4-只向正极移动 | |
| C. | 充电时,阳极附近溶液的酸性增强 | |
| D. | 充电时,阴极的电极反应式为Pb2+-2e-=Pb |
1.二氧化碳与氢气催化合成甲醇,发生的反应为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-46kJ•mol-1
(1)甲醇可与钠反应,写出反应的化学方程式:2CH3OH+2Na→2CH3ONa+H2↑.
(2)已知H-H、C-O、C═0、H-O键的键能依次为436kJ•mol-1、326kJ•mol-1、803kJ•mol-1、464kJ•mol-1,则C-H键的键能为414kJ•mol-1.
(3)一定条件下,将n(CO2):n(H2)=1:1的混合气充入绝热恒容密闭容器中发生反应,下列事实可以说明该反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)已达到平衡的是BCD(填字母)
A、容器内气体密度保持不变 B、CO2的体积分数保持不变
C、该反应的平衡常数保持不变 D、混合气体的平均相对分子质量不变
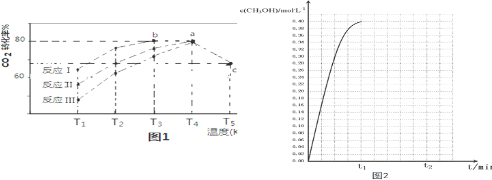
(4)一定条件下,往2L恒容密闭容器中充入1.2molCO2和3.6molH2,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g).在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,在相同时间内CO2转化率随温度变化的数据如表所示,根据表中数据绘制如图(T5时,图中c点转化率为66.67%,即转化了$\frac{2}{3}$):
①催化剂效果最佳的反应是Ⅰ(填“Ⅰ”、“Ⅱ”、“Ⅲ”)
②T3的b点v(正)=v(逆).(填“>”“<”“=”)
③T4的a点转化率比T5的c点高原因是T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低..
④在温度为T5时,该反应的平衡常数K=3.70.
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-46kJ•mol-1
(1)甲醇可与钠反应,写出反应的化学方程式:2CH3OH+2Na→2CH3ONa+H2↑.
(2)已知H-H、C-O、C═0、H-O键的键能依次为436kJ•mol-1、326kJ•mol-1、803kJ•mol-1、464kJ•mol-1,则C-H键的键能为414kJ•mol-1.
(3)一定条件下,将n(CO2):n(H2)=1:1的混合气充入绝热恒容密闭容器中发生反应,下列事实可以说明该反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)已达到平衡的是BCD(填字母)
A、容器内气体密度保持不变 B、CO2的体积分数保持不变
C、该反应的平衡常数保持不变 D、混合气体的平均相对分子质量不变
(4)一定条件下,往2L恒容密闭容器中充入1.2molCO2和3.6molH2,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g).在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,在相同时间内CO2转化率随温度变化的数据如表所示,根据表中数据绘制如图(T5时,图中c点转化率为66.67%,即转化了$\frac{2}{3}$):
| 相同时间内CO2转化率 | T1 | T2 | T3 | T4 | T5 |
| 反应Ⅰ | 65% | 77% | 80% | 80% | 66.67% |
| 反应Ⅱ | 56% | 67% | 76% | 80% | 66.67% |
| 反应Ⅲ | 48% | 62% | 72% | 80% | 66.67% |
②T3的b点v(正)=v(逆).(填“>”“<”“=”)
③T4的a点转化率比T5的c点高原因是T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低..
④在温度为T5时,该反应的平衡常数K=3.70.

5.下列物质中,属于离子化合物的是( )
| A. | N2 | B. | CO2 | C. | NaOH | D. | CH4 |
15.合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H<0,在合成氨工业生产中应采取的适宜条件是( )
| A. | 低温、高压、催化剂 | B. | 高温、高压 | ||
| C. | 尽可能的高温、高压 | D. | 适宜的温度、高压、催化剂 |
2.一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应,2SO2(g)+O2(g)?2SO3(g).反应过程中测定的部分数据见下表(表中t1<t2),下列说法正确的是( )
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10 mol SO3和0.010 mol O2,到达平衡时,n(SO2)=0.012 mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.007 0 mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050 mol SO2和0.030 mol O2,达到平衡时SO2转化率大于88% |
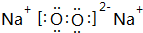 ;属于离子化合物(填“离子”或“共价”);
;属于离子化合物(填“离子”或“共价”); ;属于共价化合物(填“离子”或“共价”);
;属于共价化合物(填“离子”或“共价”);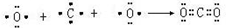 ;
;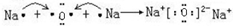 .
.