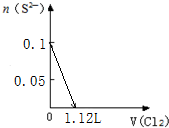
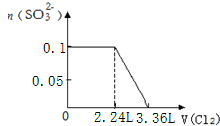
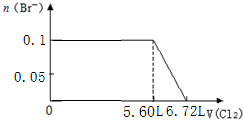
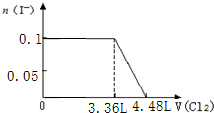
题目内容
4.晶体从溶液中析出的过程称为结晶,结晶的方法有蒸发溶剂、冷却热饱和溶液等.(1)已知某盐在不同温度下的溶解度(见下表)
| T/℃ | 0 | 10 | 20 | 30 | 40 |
| S(g/100g水) | 11.5 | 15.1 | 19.4 | 24.4 | 37.6 |
A.0℃~10℃B.10℃~20℃C.20℃~30℃D.30℃~40℃
(2)t℃时,CuSO4在水中溶解度为25g,将32g CuSO4白色粉末加入到mg水中,形成饱和CuSO4溶液,并有CuSO4•5H2O晶体析出,则m的取值范围是18<m<128.
(3)向50mL 4mol/L的NaOH溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.97g.请通过计算确定该无水物的成分.
(4)下面是四种盐在不同温度下的溶解度(克/100克水)
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
取23.4g NaCl和40.4g KNO3,加70.0g H2O,加热溶解.在100℃时蒸发掉50.0g H2O,维持该温度,过滤出晶体,计算所得晶体质量m1的值.将滤液冷却至10℃,待充分结晶后,过滤,计算所得晶体的质量m2的值.
分析 (1)根据析出晶体时的质量分数为22%,计算该溶液的溶解度S,以此判断所在的温度范围;
(2)一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质在这种溶剂中的溶解度.根据溶解度的定义并运用极限法计算;
(3)注意反应顺序:NaOH先和H2S反应生成NaHS,若NaOH还有剩余,则NaOH继续和NaHS反应生成Na2S;
(4)根据100℃蒸发后的溶液中NaCl为饱和溶液,KNO3为不饱和溶液,求出溶液中NaCl的质量,然后求出析出的NaCl晶体;将滤液冷却至10℃,NaCl为饱和溶液,KNO3为饱和溶液,分别求出溶液中NaCl、KNO3的质量,然后求出析出的NaCl、KNO3晶体的质量.
解答 解:(1)设质量百分比浓度为22%的饱和溶液的溶解度为S,
则有:$\frac{s}{s+100}$=22%,解得S=28.20g,则该盐溶液由50℃逐渐冷却,则开始析出晶体的温度范围是30~40℃.
故选:D;
(2)a.假设正好形成了CuSO4.5H2O晶体,则$\frac{32}{m}$,m=18;
b.假设正好形成饱和溶液,则溶质质量为32g,溶剂质量为mg,故$\frac{25}{100}$=$\frac{32}{m}$,m=128,由于形成饱和CuSO4溶液并有CuSO4•5H2O晶体析出,故m的取值范围为:18<m<128;
故答案为:18<m<128;
(3)设8克NaOH完全反应转化为硫氢化钠,其质量为x
NaOH+H2S=NaHS+H2O
40 56
8g x
x=$\frac{8g×56}{40}$=11.2g,
即8克NaOH完全反应可生成硫化钠的质量为11.2g,
设8克NaOH完全反应只生成硫化钠,其质量为y,
2NaOH+H2S=Na2S+2H2O
80 78
8g y
y=$\frac{8g×78}{80}$=7.8g,
即8克NaOH完全反应可生成硫化钠的质量为7.8g,
固体质量在7.8-8之间,可以是NaOH和Na2S,也可以是Na2S和NaHS,但若在8-11.2之间,则是Na2S和NaHS,
由8g>7.97g>7.8g,则产物:可以是NaOH和Na2S,也可以是Na2S和NaHS;
若产物为NaOH和Na2S,设氢氧化钠物质的量为a,硫化钠物质的量为b,则:
a+2b=0.2;
40a+78b=7.97;
解得:a=0.17mol;b=0.015mol;
若产物为Na2S和NaHS,设硫化钠物质的量为a,硫氢化钠物质的量为b,则:
2a+b=0.2;
78a+56b=7.97;
解得a=0.095mol;b=0.01mol;
答:①NaOH 0.17mol、Na2S 0.015mol ②NaHS 0.01mol、Na2S 0.095mol;
(4)100℃蒸发掉50.0克H2O后溶液中NaCl的质量为 39.1g×$\frac{70.0g-50.0g}{100g}$=7.82g,
析出的NaCl晶体质量m(高温)=23.4g-7.82g=15.58g;
冷却到10℃,析出的NaCl晶体质量为 (39.1g-35.7g)×$\frac{70.0g-50.0g}{100g}$=0.68g,
溶液中KNO3的质量为20.9g×$\frac{70.0g-50.0g}{100g}$=4.18g,
析出的KNO3晶体质量为40.4g-4.18g=36.2g,
所以10℃析出的晶体总质量m(低温)=0.68g+36.2g=36.9g,
答:m1=15.58g;m2=36.9g.
点评 本题考查了溶液质量分数计算,明确溶解度概念及与质量分数换算是解题关键,注意极限法在解题过程中的应用,题目难度较大.

 名校课堂系列答案
名校课堂系列答案| A. | K+、Na+、SO42-、Cl2 | B. | Ca2+、Na+、Br-、CO32- | ||
| C. | Na+、Fe2+、Cl-、NO3- | D. | K+、Ag+、NH3•H2O、NO3- |
| A. | 低温、高压、催化剂 | B. | 高温、高压 | ||
| C. | 尽可能的高温、高压 | D. | 适宜的温度、高压、催化剂 |
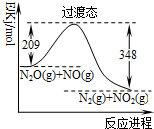
| A. | 使用催化剂可以降低过渡态的能量 | |
| B. | 反应物能量之和大于生成物能量之和 | |
| C. | N2O(g)+NO(g)→N2(g)+NO2(g)+139kJ | |
| D. | 反应物的键能总和大于生成物的键能总和 |
②2Na(s)+O2(g)=Na2O2(s) 放出511kJ的热量
下列说法正确的是( )
| A. | ①和②产物含有阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率越来越快 | |
| D. | 25℃.101kPa下:Na2O2(s)+2Na(s)═2Na2O(S) 放出317kJ的热量 |
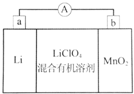 锂锰电池的体积小、性能优良,是常用的一次电池.该电池基本原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列说法正确的是( )
锂锰电池的体积小、性能优良,是常用的一次电池.该电池基本原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列说法正确的是( )| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池负极反应式为MnO2+e-+Li+=LiMnO2 | |
| C. | 该电池电解液可用LiClO4水溶液代替 | |
| D. | 从废旧锂锰电池的正极材料中可回收金属Li、Mn |

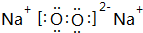 ;属于离子化合物(填“离子”或“共价”);
;属于离子化合物(填“离子”或“共价”); ;属于共价化合物(填“离子”或“共价”);
;属于共价化合物(填“离子”或“共价”);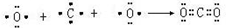 ;
;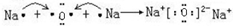 .
.