题目内容
8.硝酸与金属反应时,浓度越稀还原产物价态越低.现用一定量的铝粉与镁粉组成的混合物与100mL硝酸钾溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,向反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与产生的沉淀质量的关系如图所示.下列结论正确的是( )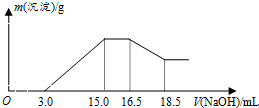
| A. | 铝与混合溶液反应的离子方程式为8Al+30H++3NO3-→8Al3++3NH4++9H2O | |
| B. | 参加反应硝酸根离子物质的量为0.06mol | |
| C. | 参加反应的铝与镁的质量之比为4:3 | |
| D. | 混合液中硫酸的物质的量的浓度为0.36mol/L |
分析 A.根据信息中硝酸与金属反应时,浓度越稀还原产物价态越低,结合反应过程中无任何气体放出,则金属与混合溶液反应生成铵根离子;
B.由图可知,从15.0mL到16.5mL区间内发生的反应是氢氧根离子与铵根离子的反应,由氮原子守恒可知,铵根离子的物质的量即为原溶液中反应的硝酸根离子的物质的量;
C.由图可知,16.5mL到18.5mL区间内发生的反应是氢氧化铝与氢氧化钠的反应,3.0mL到15.0mL区间发生的是金属离子结合生成沉淀,然后利用反应来计算;
D.由4Mg+10H++NO3-═4Mg2++NH4++3H2O、8Al+30H++3NO3-=8Al3++3NH4++9H2O及图中开始3.0mLNaOH溶液消耗的酸,计算混合液中硫酸的物质的量的浓度.
解答 解:A.硝酸根浓度很低时被氧化的产物是铵根离子,因此无气体放出,镁、铝反应生成金属阳离子,则离子反应分别为4Mg+10H++NO3-═4Mg2++NH4++3H2O、8Al+30H++3NO3-=8Al3++3NH4++9H2O,故A正确;
B.由图示可以看出加入氢氧化钠溶液从15.0mL到16.5mL区间内发生的反应是氢氧根离子与铵根离子的反应,由氮原子守恒可知,铵根离子的物质的量即为原溶液中反应的硝酸根离子的物质的量,则原溶液中NO3-物质的量是(16.5-15)×10-3L×4mol/L=0.006mol,故B错误;
C.从图示提示中看出从氢氧化溶液体积16.5mL到18.5mL区间内发生的反应是氢氧化铝与氢氧化钠的反应,氢氧化铝与氢氧化钠等物质的量反应,由Al~Al3+~Al(OH)3~NaOH,则Al的物质的量为0.008mol,再由Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,沉淀镁离子和铝离子共消耗氢氧化钠溶液体积(15.0-3.0)mL,由此可知:沉淀镁离子时消耗的氢氧根离子物质的量为(15.0-3.0)×10-3L×4.00mol/L-8×10-3mol×3=24×10-3mol,镁离子物质的量为1.2×10-2mol,参加反应的镁与铝的质量之比:8×10-3mol×27g/mol:1.2×10-2mol×24g/mol=3:4,故C错误;
D.由4Mg+10H++NO3-═4Mg2++NH4++3H2O、8Al+30H++3NO3-=8Al3++3NH4++9H2O可知,消耗氢离子为0.008mol×$\frac{30}{8}$+1.2×10-2mol×$\frac{10}{4}$=0.06mol,图中开始3.0mLNaOH溶液消耗氢离子的物质的量为3×10-3L×4mol/L=0.012mol,原溶液中硫酸的物质的量为$\frac{0.06mol+0.012mol}{2}$=0.036mol,混合液中硫酸的物质的量的浓度为$\frac{0.036mol}{0.1L}$=0.36mol/L,故D正确.
故选AD.
点评 本题难度较大,考查金属与酸性条件下硝酸盐溶液的反应,注意硝酸浓度越低生成的还原产物价态越低与反应中无气体生成相结合来分析,并注意图象与化学反应的对应来分析解答.

 智能训练练测考系列答案
智能训练练测考系列答案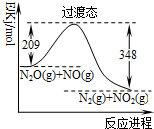
| A. | 使用催化剂可以降低过渡态的能量 | |
| B. | 反应物能量之和大于生成物能量之和 | |
| C. | N2O(g)+NO(g)→N2(g)+NO2(g)+139kJ | |
| D. | 反应物的键能总和大于生成物的键能总和 |
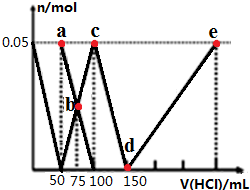
| A. | 原混合溶液中的n(CO32-):n(AlO2-)=1:1 | |
| B. | a点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-) | |
| C. | b点溶液中浓度顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-) | |
| D. | d→e的过程中水的电离程度逐渐减小 |
②2Na(s)+O2(g)=Na2O2(s) 放出511kJ的热量
下列说法正确的是( )
| A. | ①和②产物含有阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率越来越快 | |
| D. | 25℃.101kPa下:Na2O2(s)+2Na(s)═2Na2O(S) 放出317kJ的热量 |
| 选 项 | A | B | C | D |
| 实验操作或装置 | 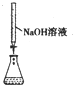 | 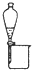 | 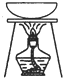 |  |
| 实验目的 | 准确量取25.00mLNaOH溶液 | 分离乙醇与乙酸乙酯 | 从KI和I2的混合物中回收I2 | 实验室制取SO2 |
| A. | A | B. | B | C. | C | D. | D |

| A. | 石墨与O2生成CO2的反应是吸热反应 | |
| B. | 等量金刚石和石墨完全燃烧,金刚石放出热量更多 | |
| C. | 从能量角度看,金刚石比石墨更稳定 | |
| D. | C(金刚石,s)→C(石墨,s)+Q kJ Q=E3-E2 |
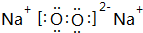 ;属于离子化合物(填“离子”或“共价”);
;属于离子化合物(填“离子”或“共价”); ;属于共价化合物(填“离子”或“共价”);
;属于共价化合物(填“离子”或“共价”);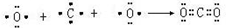 ;
; .
.