题目内容
9.一定量的浓硝酸与44.8g的铜反应,铜片完全溶解后收集到标况下混合气体NO和NO2的体积为22.4L,不考虑NO2与N2O4的相互转化,试计算下列相关问题:(要求写出计算过程)(1)消耗的硝酸物质的量.
(2)混合气体中NO2、NO的体积.
(3)相同条件下,上述反应生成的NO2、NO分别被水恰好吸收时所需的O2体积比.
分析 发生反应为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,n(Cu)=$\frac{44.8g}{64g/mol}$=0.7mol,结合原子守恒、化合价升降守恒及反应计算.
解答 解:发生反应为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(1)n(Cu)=$\frac{44.8g}{64g/mol}$=0.7mol,n(气体)=$\frac{22.4L}{22.4L/mol}$=1mol,根据N原子守恒得参加反应的n(HNO3)=2n(Cu)+n(气体)=2×0.7mol+1 mol=2.4mol,
答:参加反应的硝酸的物质的量是2.4mol;
(2)设NO2和NO分别为xmol、ymol,
混合气体中N原子的物质的量之和为1mol,则x+y=1→①,
根据化合价升降守恒知同元素化合价的升高=氮元素的化合价降低,x+3y=0.7×2→②,
解得x=0.8mol,y=0.2mol,
所以V(NO)=0.2mol×22.4L/mol=4.48L;V(NO2)=0.8mol×22.4L/mol=17.92L,
答:混合气体中V(NO)=4.48L;V(NO2)=17.92L;
(3)根据整个过程分析,要计算上述反应生成的NO2、NO分别被水恰好吸收时所需的O2体积比,则氧气化合价的降低等于氮元素化合价升高,
故NO需氧气的体积=$\frac{3×0.2}{4}×22.4$=3.36L,NO2需氧气的体积=$\frac{0.8×1}{4}×22.4$=4.48L.
答:上述反应生成的NO2、NO分别被水恰好吸收时所需的O2体积比=4.48:3.36=4:3.
点评 本题考查化学反应方程式的计算,为高频考点,把握原子守恒和电子守恒为解答的关键,侧重分析能力、计算能力的考查,题目难度不大.

| 选 项 | A | B | C | D |
| 实验操作或装置 | 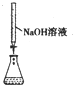 | 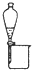 | 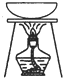 |  |
| 实验目的 | 准确量取25.00mLNaOH溶液 | 分离乙醇与乙酸乙酯 | 从KI和I2的混合物中回收I2 | 实验室制取SO2 |
| A. | A | B. | B | C. | C | D. | D |
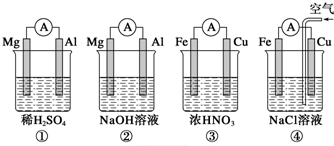
| A. | ①②中Mg作负极,③④中Fe作负极 | |
| B. | ②中Mg作正极,OH-向Al电极移动 | |
| C. | ③中Fe作负极,电极反应式为Fe-2e-=Fe2+ | |
| D. | ④中Cu作正极,电极反应式为2Na++2e-=2Na |
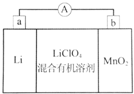 锂锰电池的体积小、性能优良,是常用的一次电池.该电池基本原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列说法正确的是( )
锂锰电池的体积小、性能优良,是常用的一次电池.该电池基本原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列说法正确的是( )| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池负极反应式为MnO2+e-+Li+=LiMnO2 | |
| C. | 该电池电解液可用LiClO4水溶液代替 | |
| D. | 从废旧锂锰电池的正极材料中可回收金属Li、Mn |
| A. | 原子半径:W>Z>Y | |
| B. | 元素Y的简单气态氢化物的热稳定性比W的弱 | |
| C. | 元素W最高价氧化物的水化物为强酸 | |
| D. | 化合物从X2Y、Z2Y中化学键的类型相同 |

| A. | 石墨与O2生成CO2的反应是吸热反应 | |
| B. | 等量金刚石和石墨完全燃烧,金刚石放出热量更多 | |
| C. | 从能量角度看,金刚石比石墨更稳定 | |
| D. | C(金刚石,s)→C(石墨,s)+Q kJ Q=E3-E2 |
| A. | C4H10 | B. | C3H8 | C. | C2H6 | D. | CH4 |
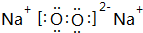 ;属于离子化合物(填“离子”或“共价”);
;属于离子化合物(填“离子”或“共价”); ;属于共价化合物(填“离子”或“共价”);
;属于共价化合物(填“离子”或“共价”);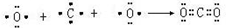 ;
;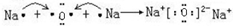 .
.