题目内容
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是 (用离子方程式解释).
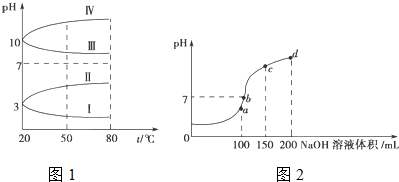
(2)均为0.1mol?L-1的几种电解质溶液的pH随温度变化的曲线如图1所示.其中符合0.1mol?L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是 (填字母),导致pH随温度变化的原因是 ;
②20℃时,0.1mol?L-1 NH4Al(SO4)2溶液中2c(SO42-)-c(NH4+)-3c(Al3+)= .
(3)室温时,向100mL 0.1mol?L-1 NH4HSO4溶液中滴加0.1mol?L-1 NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图中a、b、c、d四个点,水的电离程度最大的是 点,在b点,溶液中各离子浓度由大到小的排列顺序是 .

(1)NH4Al(SO4)2可作净水剂,其原理是
(2)均为0.1mol?L-1的几种电解质溶液的pH随温度变化的曲线如图1所示.其中符合0.1mol?L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是
②20℃时,0.1mol?L-1 NH4Al(SO4)2溶液中2c(SO42-)-c(NH4+)-3c(Al3+)=
(3)室温时,向100mL 0.1mol?L-1 NH4HSO4溶液中滴加0.1mol?L-1 NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图中a、b、c、d四个点,水的电离程度最大的是
考点:离子浓度大小的比较,影响盐类水解程度的主要因素,盐类水解的应用
专题:
分析:(1)Al3+水解生成的Al(OH)3胶体,具有吸附性;
(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大;
②根据电荷守恒定律解题;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3?H2O,(NH4)2SO4可以促进水的电离,而NH3?H2O抑制水的电离.b点溶液呈中性.
(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大;
②根据电荷守恒定律解题;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3?H2O,(NH4)2SO4可以促进水的电离,而NH3?H2O抑制水的电离.b点溶液呈中性.
解答:
解:(1)Al3+水解生成的Al(OH)3胶体,具有吸附性,离子方程式:Al3++3H2O═Al(OH)3胶体+3H+,故答案为:Al3+水解生成的Al(OH)3胶体,具有吸附性,即Al3++3H2O═Al(OH)3胶体+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水;
(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ,
故答案为:Ⅰ;NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小;
②根据电荷守恒,可以求出2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3 mol?L-1[c(OH-)太小,可忽略],故答案为:10-3 mol?L-1;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3?H2O,(NH4)2SO4可以促进水的电离,而NH3?H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3?H2O三种成分,a点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:a;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ,
故答案为:Ⅰ;NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小;
②根据电荷守恒,可以求出2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3 mol?L-1[c(OH-)太小,可忽略],故答案为:10-3 mol?L-1;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3?H2O,(NH4)2SO4可以促进水的电离,而NH3?H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3?H2O三种成分,a点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:a;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
点评:本题考查盐类的水解和离子浓度大小的比较,题目难度较大,(2)②为易错点,注意根据守恒思想解题.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
石墨和黏土按照不同的比例加以混和、压制,就可以制成铅笔芯.如果铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1mg.那么一个铅笔字含有的碳原子数约为( )
| A、2.5×1019个 |
| B、2.5×1022个 |
| C、5×1019个 |
| D、5×1022个 |
由Zn、Fe、Mg、Al四种金属中的两种组成的混合物10g与足量的盐酸反应产生1.0g H2,则混合物中一定含有的金属是( )
| A、Zn | B、Fe | C、Al | D、Mg |
已知HA与HB均为弱酸,且HA的酸性比HB弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列正确的是( )
| A、c(HA)>c(HB) |
| B、c(A-)>c(B-) |
| C、c(H+)>c(OH-) |
| D、c(A-)+c(B-)>c(Na+) |
 X、Y、Z、D、P、Q、E、G八种短周期元素的原子序数依次递增.X、Y、D元素原子中电子层数与未成对电子数均相等;D、E属于同族元素,G的单质的水溶液和ED2均有漂白性.P与X同主族,Q是生活中常见的金属.
X、Y、Z、D、P、Q、E、G八种短周期元素的原子序数依次递增.X、Y、D元素原子中电子层数与未成对电子数均相等;D、E属于同族元素,G的单质的水溶液和ED2均有漂白性.P与X同主族,Q是生活中常见的金属.
 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下: