题目内容
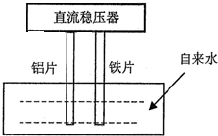 一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比.当电解器(示意图如图)插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀.根据上述现象,下列选项说法正确的是( )
一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比.当电解器(示意图如图)插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀.根据上述现象,下列选项说法正确的是( )| A、通电时,铝片做阳极,铁片做阴极 |
| B、生成的气泡、红棕色或灰绿色的沉淀都是电解的直接产物 |
| C、通过对比,确实能说明自来水中含有大量对人体有毒有害的物质 |
| D、铝片的电极反应:2H++2e-=H2↑ |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:电解自来水时冒出气泡并生成灰绿色或红棕色的沉淀,铁作阳极,铝作阴极,阳极上铁失电子生成亚铁离子,阴极上氢离子得电子生成氢气,同时溶液中生成氢氧根离子,亚铁离子和氢氧根离子反应生成白色沉淀氢氧化亚铁,氢氧化亚铁不稳定易被氧化,立即变为灰绿色,最终变为红褐色.
解答:
解:A.通电时,铝作阴极,铁作阳极,故A错误;
B.阴极上氢离子得电子生成氢气,同时溶液中产生氢氧根离子,阳极上铁失电子生成亚铁离子,亚铁离子和氢氧根离子反应生成白色沉淀氢氧化亚铁,氢氧化亚铁不稳定,易被氧化生成氢氧化铁,所以白色沉淀立即变为灰绿色,最终变为红褐色,所以这些物质不都是电解的直接产物,故B错误;
C.根据B知,不法商贩是利用铁作阳极、铝作阴极,通过电解方法生成氢氧化亚铁、氢氧化铁而欺骗市民的,故C错误;
D.铝片上氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,故D正确;
故选D.
B.阴极上氢离子得电子生成氢气,同时溶液中产生氢氧根离子,阳极上铁失电子生成亚铁离子,亚铁离子和氢氧根离子反应生成白色沉淀氢氧化亚铁,氢氧化亚铁不稳定,易被氧化生成氢氧化铁,所以白色沉淀立即变为灰绿色,最终变为红褐色,所以这些物质不都是电解的直接产物,故B错误;
C.根据B知,不法商贩是利用铁作阳极、铝作阴极,通过电解方法生成氢氧化亚铁、氢氧化铁而欺骗市民的,故C错误;
D.铝片上氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,故D正确;
故选D.
点评:本题以信息给予为载体考查了电解原理,根据实验现象知,铁作阳极铝作阴极,活泼金属作阳极,阳极上金属失电子发生氧化反应而不是电解质溶液中阴离子发生氧化反应,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
镍--镉(Ni--Cd)可充电电池可以发生如下反应:
Cd(OH)2+2Ni(OH)2
Cd+2NiO(OH )+2H2O
由此可知,该电池充电时的阳极是( )
Cd(OH)2+2Ni(OH)2
| 充电 |
| 放电 |
由此可知,该电池充电时的阳极是( )
| A、Cd |
| B、NiO(OH) |
| C、Cd(OH)2 |
| D、Ni(OH)2 |
已知25℃时,0.1mol/L的碳酸氢钠溶液的pH为8.4,则关于该溶液的叙述错误的是( )
| A、滴加甲基橙溶液呈黄色 | ||||
| B、c(HCO3-)>c(H2CO3)>c(CO32-) | ||||
| C、c(OH-)=c(H+)+c(H2CO3)-c(CO32-) | ||||
D、加水稀释,
|
某溶液中可能存在Fe3+、Fe2+、I-、HCO3-、Cl-、NO3-六种离子中的几种.进行下列实验:
①取少量溶液滴加KSCN溶液,溶液呈血红色;
②另取少量原溶液滴加盐酸,溶液的棕黄色加深.
据此可以推断,该溶液中肯定不能大量存在的离子是( )
①取少量溶液滴加KSCN溶液,溶液呈血红色;
②另取少量原溶液滴加盐酸,溶液的棕黄色加深.
据此可以推断,该溶液中肯定不能大量存在的离子是( )
| A、I- |
| B、HCO3- |
| C、Fe2+ |
| D、NO3- |
能正确表示下列反应的离子方程式的是( )
| A、浓盐酸与铁屑反应:2Fe+6H+═2 Fe3++3H2↑ |
| B、钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ |
| C、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| D、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题: .现有乙酰水杨酸的粗品,某同学用中和法测定产品纯度:取a g产品溶解于V1 mL 1mol/L的NaOH溶液中,加热使乙酰水杨酸水解,再用1mol/L的盐酸滴定过量的NaOH,当滴定终点时消耗盐酸V2 mL;
.现有乙酰水杨酸的粗品,某同学用中和法测定产品纯度:取a g产品溶解于V1 mL 1mol/L的NaOH溶液中,加热使乙酰水杨酸水解,再用1mol/L的盐酸滴定过量的NaOH,当滴定终点时消耗盐酸V2 mL; I.将0.050molSO2和0.030molO2放入容积为1L的密闭容器A中;将0.100molSO2和0.060molO2放入容积为1L的密闭容器B中,反应:2SO2(g)+O2(g)?2SO3(g);△H=-196.6kJ?mol-1,恒温恒容下达到平衡时,测得容器A中放出3.932kJ的热量,则容器A中SO2的平衡转化率为
I.将0.050molSO2和0.030molO2放入容积为1L的密闭容器A中;将0.100molSO2和0.060molO2放入容积为1L的密闭容器B中,反应:2SO2(g)+O2(g)?2SO3(g);△H=-196.6kJ?mol-1,恒温恒容下达到平衡时,测得容器A中放出3.932kJ的热量,则容器A中SO2的平衡转化率为