题目内容
镍--镉(Ni--Cd)可充电电池可以发生如下反应:
Cd(OH)2+2Ni(OH)2
Cd+2NiO(OH )+2H2O
由此可知,该电池充电时的阳极是( )
Cd(OH)2+2Ni(OH)2
| 充电 |
| 放电 |
由此可知,该电池充电时的阳极是( )
| A、Cd |
| B、NiO(OH) |
| C、Cd(OH)2 |
| D、Ni(OH)2 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2可知,放电时Cd为负极,放电时阴离子向负极移动,充电时阴极与负极相连,正极与阳极相连,充电时阳极发生氧化反应为Ni(OH)2-e-+OH-=NiOOH+H2O,以此来解答.
| 放电 |
| 充电 |
解答:
解:由Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2可知,放电时Cd为负极,放电时阴离子向负极移动,充电时阴极与负极相连,正极与阳极相连,充电时阳极发生氧化反应为Ni(OH)2-e-+OH-=NiOOH+H2O,电池充电时的阳极是Ni(OH)2,
故选D.
| 放电 |
| 充电 |
故选D.
点评:本题考查原电池和电解原理,把握放电为原电池、充电为电解过程为解答的关键,注意利用化合价变化分析电极、电极反应,明确正负极与阴阳极的连接即可解答,题目难度中等.

练习册系列答案
相关题目
下列实验I~Ⅳ中,正确的是( )


| A、实验Ⅰ:配置一定物质的量浓度的溶液 |
| B、实验Ⅱ:除去Cl2中的HCl |
| C、实验Ⅲ:用水吸收NH3 |
| D、实验Ⅳ:石油的分馏 |
设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、常温下,14g C2H4含有nA个氢原子 |
| B、1mol C和足量浓硫酸完全反应转移4nA个电子 |
| C、1L 0.1mol?L-1的Na2CO3溶液含有0.1nA个CO32- |
| D、标准状况下,22.4L CH3CH2OH含有个nA个CH3CH2OH分子 |
对下列各组物质关系的描述中正确的是( )
A、 与 与 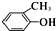 属于同素异形体 属于同素异形体 |
| B、CH3COOH与硬脂酸(C17H35COOH)属于同系物 |
C、 与 与  属于同一种物质 属于同一种物质 |
D、 与 与 属于同分异构体 属于同分异构体 |
下列物质之间的相互关系错误的是( )
| A、CH3-CH2-NO2和N2H-CH2-COOH互为同分异构体 |
| B、O2和O3互为同素异形体 |
| C、CH3CH3和CH3CH3CH互为同系物 |
| D、干冰和冰为同一种物质 |
下列说法正确的是( )
| A、已知a g乙烯气体充分燃烧时生成1 mol CO2和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)═4CO2(g)+4H2O(l)△H=-4b kJ?mol-1 |
| B、已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ?mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量数值小于270 kJ |
| C、常温常压下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ?mol-1 |
| D、已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ?mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ?mol-1,则C(s,金刚石)═C(s,石墨)△H=-1.5 kJ?mol-1 |
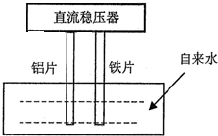 一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比.当电解器(示意图如图)插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀.根据上述现象,下列选项说法正确的是( )
一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比.当电解器(示意图如图)插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀.根据上述现象,下列选项说法正确的是( )| A、通电时,铝片做阳极,铁片做阴极 |
| B、生成的气泡、红棕色或灰绿色的沉淀都是电解的直接产物 |
| C、通过对比,确实能说明自来水中含有大量对人体有毒有害的物质 |
| D、铝片的电极反应:2H++2e-=H2↑ |



