题目内容
(1)乙酰水杨酸俗称阿司匹林,是一种历史悠久的解热镇痛药.乙酰水杨酸的结构简式为 .现有乙酰水杨酸的粗品,某同学用中和法测定产品纯度:取a g产品溶解于V1 mL 1mol/L的NaOH溶液中,加热使乙酰水杨酸水解,再用1mol/L的盐酸滴定过量的NaOH,当滴定终点时消耗盐酸V2 mL;
.现有乙酰水杨酸的粗品,某同学用中和法测定产品纯度:取a g产品溶解于V1 mL 1mol/L的NaOH溶液中,加热使乙酰水杨酸水解,再用1mol/L的盐酸滴定过量的NaOH,当滴定终点时消耗盐酸V2 mL;
①写出乙酰水杨酸与NaOH溶液反应的化学方程式 ;
②计算出产品纯度为 (只需列出计算表达式,不必化简.乙酰水杨酸相对分子质量为180).
(2)甲醇直接燃料电池具有启动快、效率高、能量密度高等优点.(已知二甲醚直接燃料电池能量密度E=8.39kW?h?kg-1).
①若电解质为酸性,甲醇直接燃料电池的负极反应为 ;
②该电池的理论输出电压为1.20V,能量密度E= (列式计算.能量密度=电池输出电能/燃料质量,1kW?h=3.6×106J,一个电子的电量=1.6×10-19C).
 .现有乙酰水杨酸的粗品,某同学用中和法测定产品纯度:取a g产品溶解于V1 mL 1mol/L的NaOH溶液中,加热使乙酰水杨酸水解,再用1mol/L的盐酸滴定过量的NaOH,当滴定终点时消耗盐酸V2 mL;
.现有乙酰水杨酸的粗品,某同学用中和法测定产品纯度:取a g产品溶解于V1 mL 1mol/L的NaOH溶液中,加热使乙酰水杨酸水解,再用1mol/L的盐酸滴定过量的NaOH,当滴定终点时消耗盐酸V2 mL;①写出乙酰水杨酸与NaOH溶液反应的化学方程式
②计算出产品纯度为
(2)甲醇直接燃料电池具有启动快、效率高、能量密度高等优点.(已知二甲醚直接燃料电池能量密度E=8.39kW?h?kg-1).
①若电解质为酸性,甲醇直接燃料电池的负极反应为
②该电池的理论输出电压为1.20V,能量密度E=
考点:有机物的结构和性质,常见化学电源的种类及其工作原理
专题:氧化还原反应专题,有机物的化学性质及推断
分析:(1)①乙酰水杨酸含有酯基和羧基,都可与氢氧化钠反应;
②根据消耗盐酸的物质的量,结合反应的方程式可知乙酰水杨酸的物质的量,进而可计算质量分数;
(2)①酸性介质中,甲醇被氧化生成二氧化碳和水;
②计算1Kg甲醇输出的电能,结合能量密度公式计算.
②根据消耗盐酸的物质的量,结合反应的方程式可知乙酰水杨酸的物质的量,进而可计算质量分数;
(2)①酸性介质中,甲醇被氧化生成二氧化碳和水;
②计算1Kg甲醇输出的电能,结合能量密度公式计算.
解答:
解:(1)①乙酰水杨酸含有酯基和羧基,与氢氧化钠反应的方程式为 ,
,
故答案为: ;
;
②n(HCl)=V2×10-3mol,则与乙酰水杨酸反应的氢氧化钠的物质的量为(V1-V2)×10-3mol,
由方程式 可知乙酰水杨酸的物质的量为
可知乙酰水杨酸的物质的量为
×(V1-V2)×10-3mol,
质量为
×(V1-V2)×10-3mol×180g/mol,
质量分数为
×180×100%,
故答案为:
×180×100%;
(2)①酸性介质中,甲醇被氧化生成二氧化碳和水,电极方程式为CH3OH+H2O-6e-=CO2+6H+,故答案为:CH3OH+H2O-6e-=CO2+6H+;
②1Kg甲醇输出的电能:w=UIt=Uq=1.20×1000/32×6×6.02×1023×1.602×10-19J
=2.1699×107 J
=2.1699×107/3.6×106kW?h
=6.03 kW?h
甲醇直接燃料电池能量密度E=6.03 kW?h?kg-1.
故答案为:6.03 kW?h?kg-1.
 ,
,故答案为:
 ;
;②n(HCl)=V2×10-3mol,则与乙酰水杨酸反应的氢氧化钠的物质的量为(V1-V2)×10-3mol,
由方程式
 可知乙酰水杨酸的物质的量为
可知乙酰水杨酸的物质的量为| 1 |
| 3 |
质量为
| 1 |
| 3 |
质量分数为
| ||||
| a |
故答案为:
| ||||
| a |
(2)①酸性介质中,甲醇被氧化生成二氧化碳和水,电极方程式为CH3OH+H2O-6e-=CO2+6H+,故答案为:CH3OH+H2O-6e-=CO2+6H+;
②1Kg甲醇输出的电能:w=UIt=Uq=1.20×1000/32×6×6.02×1023×1.602×10-19J
=2.1699×107 J
=2.1699×107/3.6×106kW?h
=6.03 kW?h
甲醇直接燃料电池能量密度E=6.03 kW?h?kg-1.
故答案为:6.03 kW?h?kg-1.
点评:本题考查较为综合,涉及有机物的结构和性质以及电化学知识,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握有机物官能团的性质以及原电池的工作原理,难度不大.

练习册系列答案
相关题目
设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、常温下,14g C2H4含有nA个氢原子 |
| B、1mol C和足量浓硫酸完全反应转移4nA个电子 |
| C、1L 0.1mol?L-1的Na2CO3溶液含有0.1nA个CO32- |
| D、标准状况下,22.4L CH3CH2OH含有个nA个CH3CH2OH分子 |
不影响H2O的电离平衡的粒子是( )
A、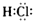 |
B、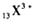 |
C、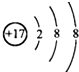 |
D、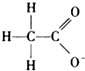 |
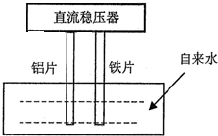 一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比.当电解器(示意图如图)插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀.根据上述现象,下列选项说法正确的是( )
一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比.当电解器(示意图如图)插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀.根据上述现象,下列选项说法正确的是( )| A、通电时,铝片做阳极,铁片做阴极 |
| B、生成的气泡、红棕色或灰绿色的沉淀都是电解的直接产物 |
| C、通过对比,确实能说明自来水中含有大量对人体有毒有害的物质 |
| D、铝片的电极反应:2H++2e-=H2↑ |
能正确表示下列反应的离子方程式是( )
| A、向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | ||||
B、三氯化铁浓溶液滴入沸水中,制取氢氧化铁胶体Fe3++3H2O
| ||||
C、碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-
| ||||
| D、铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑ |
 一定温度下对冰醋酸逐滴加水稀释,发生如图变化,图中Y轴的含义可能是( )
一定温度下对冰醋酸逐滴加水稀释,发生如图变化,图中Y轴的含义可能是( )| A、导电能力 | B、pH |
| C、氢离子浓度 | D、溶液密度 |
 某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸.记录数据如下:
某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸.记录数据如下: