题目内容
已知25℃时,0.1mol/L的碳酸氢钠溶液的pH为8.4,则关于该溶液的叙述错误的是( )
| A、滴加甲基橙溶液呈黄色 | ||||
| B、c(HCO3-)>c(H2CO3)>c(CO32-) | ||||
| C、c(OH-)=c(H+)+c(H2CO3)-c(CO32-) | ||||
D、加水稀释,
|
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.甲基橙的变色范围为3.1-4.4;
B.0.1mol/L的碳酸氢钠溶液的pH为8.4,说明碳酸氢根离子的水解程度大于电离程度;
C.溶液中存在物料守恒和电荷守恒,根据物料守恒和电荷守恒判断;
D.加水稀释,促进碳酸氢根离子水解.
B.0.1mol/L的碳酸氢钠溶液的pH为8.4,说明碳酸氢根离子的水解程度大于电离程度;
C.溶液中存在物料守恒和电荷守恒,根据物料守恒和电荷守恒判断;
D.加水稀释,促进碳酸氢根离子水解.
解答:
解:A.甲基橙的变色范围为3.1-4.4,当pH大于4.4时,甲基橙为黄色,故A正确;
B.0.1mol/L的碳酸氢钠溶液的pH为8.4,说明碳酸氢根离子的水解程度大于电离程度,但电离程度和水解程度都较小,则c(HCO3-)>c(H2CO3)>c(CO32-),故B正确;
C.溶液中存在物料守恒和电荷守恒,根据电荷守恒得c(OH-)+2c(CO32-)+c(HCO3-)=c(H+)+c(Na+),根据物料守恒得c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-),所以得c(OH-)=c(H+)+c(H2CO3)-c(CO32-),故C正确;
D.加水稀释,促进碳酸氢根离子水解,所以,
的比值增大,故D错误;
故选D.
B.0.1mol/L的碳酸氢钠溶液的pH为8.4,说明碳酸氢根离子的水解程度大于电离程度,但电离程度和水解程度都较小,则c(HCO3-)>c(H2CO3)>c(CO32-),故B正确;
C.溶液中存在物料守恒和电荷守恒,根据电荷守恒得c(OH-)+2c(CO32-)+c(HCO3-)=c(H+)+c(Na+),根据物料守恒得c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-),所以得c(OH-)=c(H+)+c(H2CO3)-c(CO32-),故C正确;
D.加水稀释,促进碳酸氢根离子水解,所以,
| c(H2CO3) | ||
c(HC
|
故选D.
点评:本题考查了离子浓度大小的比较,根据溶液的酸碱性确定碳酸氢根离子电离和水解程度相对大小,再结合电荷守恒和物料守恒解答,知道甲基橙的变色范围,难度不大.

练习册系列答案
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
对下列各组物质关系的描述中正确的是( )
A、 与 与  属于同素异形体 属于同素异形体 |
| B、CH3COOH与硬脂酸(C17H35COOH)属于同系物 |
C、 与 与  属于同一种物质 属于同一种物质 |
D、 与 与 属于同分异构体 属于同分异构体 |
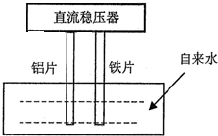 一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比.当电解器(示意图如图)插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀.根据上述现象,下列选项说法正确的是( )
一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比.当电解器(示意图如图)插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀.根据上述现象,下列选项说法正确的是( )| A、通电时,铝片做阳极,铁片做阴极 |
| B、生成的气泡、红棕色或灰绿色的沉淀都是电解的直接产物 |
| C、通过对比,确实能说明自来水中含有大量对人体有毒有害的物质 |
| D、铝片的电极反应:2H++2e-=H2↑ |
能在水溶液中大量共存的离子组是( )
| A、H+、Fe3+、SO42-、I- |
| B、H+、NH4+、HCO3-、NO3- |
| C、Ag+、K+、Cl-、SO42- |
| D、K+、AlO2-、Cl-、OH- |
向碳酸氢镁溶液中逐滴加入澄清石灰水,下列离子反应可能发生的是( )
| A、Mg2++2OH-→Mg(OH)2↓ |
| B、Mg2++2HCO3-+Ca2++2OH-→MgCO3↓+CaCO3↓+2H2O |
| C、Mg2++HCO3-+Ca2++3OH-→Mg(OH)2↓+CaCO3↓+H2O |
| D、Mg2++4HCO3-+2Ca2++4OH-→2MgCO3↓+2CaCO3↓+4H2O |
 主族元素A、B形成的阴离子如图所示,其中A、B原子最外层都已达到8电子稳定结构,则下列关于该离子的叙述肯定错误的是( )
主族元素A、B形成的阴离子如图所示,其中A、B原子最外层都已达到8电子稳定结构,则下列关于该离子的叙述肯定错误的是( )| A、n=2 |
| B、A是第ⅡA族元素 |
| C、A为-2价,B为+2价 |
| D、该离子没有还原性 |
 下列实验流程图中,X为第三周期两种重要单质的氧化物的混合物.反应②、④是工业上的重要反应,部分物质及反应条件没有列出.
下列实验流程图中,X为第三周期两种重要单质的氧化物的混合物.反应②、④是工业上的重要反应,部分物质及反应条件没有列出.