题目内容
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:(1)从如图实验装置看,其中尚缺少的一种玻璃用品是
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于
(3)若改用60mL 0.25mol?L-1H2SO4和50mL 0.55mol?L-1NaOH溶液进行反应与上述实验相比,所放出的热量
(4)倒入NaOH溶液的正确操作是:
A.沿玻璃棒缓慢倒入 B.分三次少量倒入C.一次迅速倒入
(5)使硫酸与NaOH溶液混合均匀的正确操作是:
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃棒轻轻地搅动
(6)实验数据如表:
①请填写下表中的空白:
| 温度 实验次数 |
起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
考点:中和热的测定
专题:实验题
分析:(1)根据量热计的构造来判断该装置的缺少仪器;为了减少热量的损失,大烧杯杯口与小烧杯杯口相平;
(2)中和热测定实验成败的关键是减少热量散失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)完了减少热量散失,使测量结果更加准确,需要迅速将氢氧化钠溶液倒入烧杯中;
(5)通过环形玻璃棒慢慢搅拌,可以使氢氧化钠溶液与硫酸混合均匀;
(6)①先计算出每次试验操作测定的温度差,然后舍弃误差较大的数据,最后计算出温度差平均值;
②根据Q=m?c?△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热;
③a.实验装置保温、隔热效果必须好;
b.用温度计测定NaOH溶液起始温度后,要将温度计回零直再测定H2SO4溶液的温度;
c.若分多次把NaOH溶液倒入盛有硫酸的小烧杯中,会导致散失过多的热量.
(2)中和热测定实验成败的关键是减少热量散失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(4)完了减少热量散失,使测量结果更加准确,需要迅速将氢氧化钠溶液倒入烧杯中;
(5)通过环形玻璃棒慢慢搅拌,可以使氢氧化钠溶液与硫酸混合均匀;
(6)①先计算出每次试验操作测定的温度差,然后舍弃误差较大的数据,最后计算出温度差平均值;
②根据Q=m?c?△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热;
③a.实验装置保温、隔热效果必须好;
b.用温度计测定NaOH溶液起始温度后,要将温度计回零直再测定H2SO4溶液的温度;
c.若分多次把NaOH溶液倒入盛有硫酸的小烧杯中,会导致散失过多的热量.
解答:
解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;为了减少热量的损失,大烧杯杯口与小烧杯杯口应该相平、小烧杯口用硬纸板盖住,
故答案为:环形玻璃搅拌棒;小烧杯口未用硬纸板盖住(或大烧杯内碎纸条塞少了,未将小烧杯垫的足够高);
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,
故答案为:隔热,减少热量的损失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25mol?L-1H2SO4溶液跟50mL0.55mol?L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;
故答案为:不相等;相等;
(4)中和热的测定中,必须尽量减少热量散失,所以倒入氢氧化钠溶液时,必须一次并且迅速倒入烧杯中,所以C正确,
故答案为:C;
(5)A.温度计用于测定温度,不能使用温度计搅拌溶液,故A错误;
B.揭开硬纸片用玻璃棒搅拌,会导致热量散失,影响测定结果,故B错误;
C.轻轻地振荡烧杯,会导致溶液溅出,甚至导致热量散失,影响测定结果,故C错误;
D.用套在温度计上的环形玻璃棒轻轻地搅动,可以使硫酸和氢氧化钠溶液混合均匀,又可以减少热量散失,故D正确;
故答案为:D;
(6))①第一次测定温度差为:(29.5-26.1)℃=3.4℃,
第二次测定的温度差为:(32.3-27.2)℃=5.1℃,
第三次测定的温度差为:(29.2-25.9)℃=3.3℃,
第三次测定的温度差为:(29.8-26.3)℃=3.5℃,
其中第二次的温度差误差较大,应该舍弃,其它三次温度差的平均值为:
℃=3.4℃,
故答案为:3.4;
②50mL0.55mol/L氢氧化钠与50mL0.25mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:100mL×1g/cm3=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为:Q=m?c?△T=100g×4.18J/(g?℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
=-56.8 kJ/mol,
故答案为:-56.8kJ/mol;
③a.实验装置保温、隔热效果必须好,否则测定结果偏小,故a正确;
b.用温度计测定NaOH溶液起始温度后,要将温度计回零直再测定H2SO4溶液的温度,故b正确;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,否则会导致较多热量散失,故c正确;
故答案为:abc.
故答案为:环形玻璃搅拌棒;小烧杯口未用硬纸板盖住(或大烧杯内碎纸条塞少了,未将小烧杯垫的足够高);
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,
故答案为:隔热,减少热量的损失;
(3)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25mol?L-1H2SO4溶液跟50mL0.55mol?L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;
故答案为:不相等;相等;
(4)中和热的测定中,必须尽量减少热量散失,所以倒入氢氧化钠溶液时,必须一次并且迅速倒入烧杯中,所以C正确,
故答案为:C;
(5)A.温度计用于测定温度,不能使用温度计搅拌溶液,故A错误;
B.揭开硬纸片用玻璃棒搅拌,会导致热量散失,影响测定结果,故B错误;
C.轻轻地振荡烧杯,会导致溶液溅出,甚至导致热量散失,影响测定结果,故C错误;
D.用套在温度计上的环形玻璃棒轻轻地搅动,可以使硫酸和氢氧化钠溶液混合均匀,又可以减少热量散失,故D正确;
故答案为:D;
(6))①第一次测定温度差为:(29.5-26.1)℃=3.4℃,
第二次测定的温度差为:(32.3-27.2)℃=5.1℃,
第三次测定的温度差为:(29.2-25.9)℃=3.3℃,
第三次测定的温度差为:(29.8-26.3)℃=3.5℃,
其中第二次的温度差误差较大,应该舍弃,其它三次温度差的平均值为:
| 3.4+3.3+3.5 |
| 3 |
故答案为:3.4;
②50mL0.55mol/L氢氧化钠与50mL0.25mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:100mL×1g/cm3=100g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为:Q=m?c?△T=100g×4.18J/(g?℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-
| 1.4212kJ |
| 0.025mol |
故答案为:-56.8kJ/mol;
③a.实验装置保温、隔热效果必须好,否则测定结果偏小,故a正确;
b.用温度计测定NaOH溶液起始温度后,要将温度计回零直再测定H2SO4溶液的温度,故b正确;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,否则会导致较多热量散失,故c正确;
故答案为:abc.
点评:本题考查热化学方程式以及反应热的计算,题目难度不大,注意理解中和热的概念、把握热化学方程式的书写方法,以及测定反应热的误差等问题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列实验I~Ⅳ中,正确的是( )


| A、实验Ⅰ:配置一定物质的量浓度的溶液 |
| B、实验Ⅱ:除去Cl2中的HCl |
| C、实验Ⅲ:用水吸收NH3 |
| D、实验Ⅳ:石油的分馏 |
下列说法正确的是( )
| A、已知a g乙烯气体充分燃烧时生成1 mol CO2和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)═4CO2(g)+4H2O(l)△H=-4b kJ?mol-1 |
| B、已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ?mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量数值小于270 kJ |
| C、常温常压下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ?mol-1 |
| D、已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ?mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ?mol-1,则C(s,金刚石)═C(s,石墨)△H=-1.5 kJ?mol-1 |
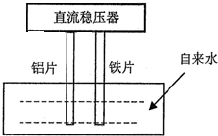 一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比.当电解器(示意图如图)插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀.根据上述现象,下列选项说法正确的是( )
一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比.当电解器(示意图如图)插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀.根据上述现象,下列选项说法正确的是( )| A、通电时,铝片做阳极,铁片做阴极 |
| B、生成的气泡、红棕色或灰绿色的沉淀都是电解的直接产物 |
| C、通过对比,确实能说明自来水中含有大量对人体有毒有害的物质 |
| D、铝片的电极反应:2H++2e-=H2↑ |
向碳酸氢镁溶液中逐滴加入澄清石灰水,下列离子反应可能发生的是( )
| A、Mg2++2OH-→Mg(OH)2↓ |
| B、Mg2++2HCO3-+Ca2++2OH-→MgCO3↓+CaCO3↓+2H2O |
| C、Mg2++HCO3-+Ca2++3OH-→Mg(OH)2↓+CaCO3↓+H2O |
| D、Mg2++4HCO3-+2Ca2++4OH-→2MgCO3↓+2CaCO3↓+4H2O |
 下列实验流程图中,X为第三周期两种重要单质的氧化物的混合物.反应②、④是工业上的重要反应,部分物质及反应条件没有列出.
下列实验流程图中,X为第三周期两种重要单质的氧化物的混合物.反应②、④是工业上的重要反应,部分物质及反应条件没有列出.