题目内容
 I.将0.050molSO2和0.030molO2放入容积为1L的密闭容器A中;将0.100molSO2和0.060molO2放入容积为1L的密闭容器B中,反应:2SO2(g)+O2(g)?2SO3(g);△H=-196.6kJ?mol-1,恒温恒容下达到平衡时,测得容器A中放出3.932kJ的热量,则容器A中SO2的平衡转化率为
I.将0.050molSO2和0.030molO2放入容积为1L的密闭容器A中;将0.100molSO2和0.060molO2放入容积为1L的密闭容器B中,反应:2SO2(g)+O2(g)?2SO3(g);△H=-196.6kJ?mol-1,恒温恒容下达到平衡时,测得容器A中放出3.932kJ的热量,则容器A中SO2的平衡转化率为II.滴定分析法是化学分析法中的重要分析方法之一.滴定分析法就是将一种已知准确浓度的试剂溶液(即标准溶液),由滴定管滴加到被测定的物质的溶液(即试液)中,直到化学反应完全时为止,然后根据所用试剂溶液的浓度和体积,就可以求得被测组分的含量.
(1)已知用0.10mol/L HCl滴定20.00ml 0.10mol/L Na2CO3的滴定曲线如图所示:
①A处选用
②当滴定至混合液pH接近4时,为了防止终点出现过早,减少实验的误差,应剧烈地摇动溶液或加热一会溶液,冷却后再继续滴定,这样做的理由是:
(2)EDTA是乙二胺四乙酸的英文名称的缩写,它是一种常用的滴定剂,市售试剂是其二水合二钠盐.下表是EDTA与一些常见金属离子形成络合物(用MY表示)的稳定常数(温度25℃):
| 阳离子 | lgKMY | 阳离子 | lgKMY |
| Na+ | 1.66 | Mn2+ | 13.87 |
| Ca2+ | 10.96 | Pb2+ | 18.04 |
根据上表给出的数据和你所学的知识,解释为什么用CaY溶液可以排除体内的铅?
考点:化学平衡的计算,中和滴定
专题:化学平衡专题,电离平衡与溶液的pH专题
分析:Ⅰ、恒温恒容下达到平衡时,测得容器A中放出3.932kJ的热量,依据化学反应焓变计算反应的二氧化硫物质的量,根据转化率概念计算得到二氧化硫转化率;分析可知A容器是恒温恒容容器,B容器为恒温恒压容器,达到平衡过程中B中压强大于A中的压强,平衡正向进行,反应速率增大分析判断;
Ⅱ、(1)①A处在碱性条件下变色;
②溶液中含有H2CO3;
(2)依据图表数据分析Pb2+与(EDTA)2-?形成络合物的稳定常数大于Ca2+与(EDTA)2-形成络合物的稳定常数,lgKMY值越大,表明金属离子与EDTA形成的络合物越稳定,越难电离;
Ⅱ、(1)①A处在碱性条件下变色;
②溶液中含有H2CO3;
(2)依据图表数据分析Pb2+与(EDTA)2-?形成络合物的稳定常数大于Ca2+与(EDTA)2-形成络合物的稳定常数,lgKMY值越大,表明金属离子与EDTA形成的络合物越稳定,越难电离;
解答:
解:Ⅰ.恒温恒容下达到平衡时,测得容器A中放出3.932kJ的热量,依据2SO2(g)+O2(g)?2SO3(g);△H=-196.6kJ?mol-1,计算可知,二氧化硫反应的物质的量=
=0.04mol,则二氧化硫转化率=
×100%=80%;将0.100molSO2和0.060molO2放入容积为1L的密闭容器B中,相当于两次加入0.050molSO2和0.030molO2放入容积为1L的密闭容器A中,增大压强,平衡正向进行,二氧化硫的转化率增大,容器B中SO2的平衡转化率大于容器A中SO2的平衡转化率,B容器中压强大于A,所以到达平衡所需时间较短;
故答案为:80%;大于; B;
Ⅱ.(1)①A处在碱性条件下变色,所以选用酚酞,故答案为:酚酞;
②溶液中含有H2CO3,加热或振荡加快H2CO3的分解,除去溶液中过多的CO2,如果是采用加热溶液的操作,则将锥形瓶放在石棉网上用酒精灯加热(或将锥形瓶放在盛有热水的烧杯中水浴加热一段时间);
故答案为:加快H2CO3的分解,除去溶液中过多的CO2;将锥形瓶放在石棉网上用酒精灯加热(或将锥形瓶放在盛有热水的烧杯中水浴加热一段时间)
(2)lgKMY值越大,表明金属离子与EDTA形成的络合物越稳定,越难电离,图表数据分析Pb2+与(EDTA)2-?形成络合物的稳定常数大于Ca2+与(EDTA)2-形成络合物的稳定常数,Ca(EDTA)2-?电离出的(EDTA)2-?能与Pb2+结合形成更稳定的络合物Pb(EDTA)2-?,从而达到排除体内铅的目的;
故答案为:Pb2+与(EDTA)2-?形成络合物的稳定常数大于Ca2+与(EDTA)2-形成络合物的稳定常数,所以Ca(EDTA)2-?电离出的(EDTA)2-?能与Pb2+结合形成更稳定的络合物Pb(EDTA)2-?,从而达到排除体内铅的目的.
| 2mol×3.932KJ |
| 196.6KJ |
| 0.04mol |
| 0.05mol |
故答案为:80%;大于; B;
Ⅱ.(1)①A处在碱性条件下变色,所以选用酚酞,故答案为:酚酞;
②溶液中含有H2CO3,加热或振荡加快H2CO3的分解,除去溶液中过多的CO2,如果是采用加热溶液的操作,则将锥形瓶放在石棉网上用酒精灯加热(或将锥形瓶放在盛有热水的烧杯中水浴加热一段时间);
故答案为:加快H2CO3的分解,除去溶液中过多的CO2;将锥形瓶放在石棉网上用酒精灯加热(或将锥形瓶放在盛有热水的烧杯中水浴加热一段时间)
(2)lgKMY值越大,表明金属离子与EDTA形成的络合物越稳定,越难电离,图表数据分析Pb2+与(EDTA)2-?形成络合物的稳定常数大于Ca2+与(EDTA)2-形成络合物的稳定常数,Ca(EDTA)2-?电离出的(EDTA)2-?能与Pb2+结合形成更稳定的络合物Pb(EDTA)2-?,从而达到排除体内铅的目的;
故答案为:Pb2+与(EDTA)2-?形成络合物的稳定常数大于Ca2+与(EDTA)2-形成络合物的稳定常数,所以Ca(EDTA)2-?电离出的(EDTA)2-?能与Pb2+结合形成更稳定的络合物Pb(EDTA)2-?,从而达到排除体内铅的目的.
点评:本题考查了化学平衡影响因素的分析判断,化学平衡计算应用,中和滴定实验的分析判断,题干信息的应用和理解是解题关键,题目难度中等.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
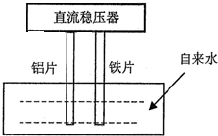 一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比.当电解器(示意图如图)插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀.根据上述现象,下列选项说法正确的是( )
一些净水器推销商在推销其产品时,进行所谓的“电解水法”实验,将纯净水与自来水进行对比.当电解器(示意图如图)插入纯净水和自来水中通电数分钟后,纯净水颜色无变化或略显黄色,而自来水却冒出气泡并生成灰绿色或红棕色的沉淀.根据上述现象,下列选项说法正确的是( )| A、通电时,铝片做阳极,铁片做阴极 |
| B、生成的气泡、红棕色或灰绿色的沉淀都是电解的直接产物 |
| C、通过对比,确实能说明自来水中含有大量对人体有毒有害的物质 |
| D、铝片的电极反应:2H++2e-=H2↑ |
下列说法正确的是( )
| A、某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B、常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH4Cl③NH3?H2O④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ |
| C、0.1 mol?L HA(一元酸)溶液与0.1mol?L-1的NaOH溶液等体积混合:c(H+)+c(Na+)=c(OH-)+c(A-) |
| D、常温下0.4 mol/L HA溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(A-)>c(H+)>c(Na+)>c(OH-) |
下列实验能达到目的是( )
A、 证明酸性:盐酸>碳酸>苯酚 |
B、 石油蒸馏 |
C、 实验室制硝基苯 |
D、 实验室制乙酸乙酯 |
