题目内容
1.根据题目要求填空:(1)Mg2+的结构示意图为
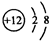 ;O的电子式为
;O的电子式为 ;H2S的结构式为H-S-H.
;H2S的结构式为H-S-H.(2)氯化钠的电子式为
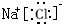 ,溶于水发生电离的电离方程式为NaCl=Na++Cl-,向氯化钠溶液中滴入硝酸银时发生反应的离子方程式为Ag++Cl-=AgCl↓.
,溶于水发生电离的电离方程式为NaCl=Na++Cl-,向氯化钠溶液中滴入硝酸银时发生反应的离子方程式为Ag++Cl-=AgCl↓.
分析 (1)Mg2+的质子数为12,电子数为10,用小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数;氧原子最外层为6个电子,据此书写电子式;H2S分子中有2对共用电子对,据此书写H2S分子的结构式;
(2)氯化钠是离子化合物,是钠离子和氯离子通过静电作用形成的,氯化钠属于强电解质,完全电离出钠离子和氯离子,氯化钠溶液中滴入硝酸银溶液发生复分解反应生成氯化银沉淀.
解答 解:(1)Mg2+的质子数为12,电子数为10,离子结构示意图为: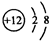 ;氧原子最外层为6个电子,O的电子式为:
;氧原子最外层为6个电子,O的电子式为: ,H2S分子中有2对共用电子对,则H2S结构式H-S-H,
,H2S分子中有2对共用电子对,则H2S结构式H-S-H,
故答案为: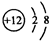 ;
; ;H-S-H;
;H-S-H;
(2)氯化钠是由钠离子和氯离子构成的,其电子式为: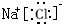 ,氯化钠为强电解质,完全电离为钠离子、氯离子,电离方程式为:NaCl=Na++Cl-,向氯化钠溶液中滴入硝酸银,银离子和氯离子反应生成氯化银,离子反应为:Ag++Cl-=AgCl↓,
,氯化钠为强电解质,完全电离为钠离子、氯离子,电离方程式为:NaCl=Na++Cl-,向氯化钠溶液中滴入硝酸银,银离子和氯离子反应生成氯化银,离子反应为:Ag++Cl-=AgCl↓,
故答案为: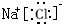 ;NaCl=Na++Cl-;Ag++Cl-=AgCl↓.
;NaCl=Na++Cl-;Ag++Cl-=AgCl↓.
点评 本题考查了离子结构示意图、电子式、电离方程式、离子方程式的书写,题目比较简单,熟悉原子核外电子排布规则、电子式的书写方法是解题的关键.

练习册系列答案
相关题目
11.(一)某课外实验活动小组拟用下列装置和药品制备无水氯化铁晶体,该物质极易潮解,100℃左右时升华,完成下列问题:
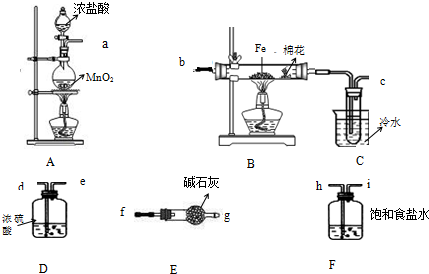
(1)不加热条件下检查A装置气密性的操作方法是将管口a封闭,向分液漏斗中注入水,打开分液漏斗活塞,水的液面不会连续下降,证明装置A的气密性良好.
(2)制备开始时A装置烧瓶中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)按气流方向连接完整装置:a→h→i→d→e→b→c→f→g(按仪器接口字母编号)
(4)若无E装置可能产生的后果是未反应的氯气污染空气,空气中的水可使无水FeCl3水解.
(5)本实验合理的操作步骤为②③①④⑥⑤(按操作顺序选择序号).
①添加药品 ②连接仪器 ③检查装置气密性 ④点燃A处酒精灯
⑤点燃B处酒精灯 ⑥使B中硬质玻璃管内充满黄绿色气体
(6)实验完毕后该组同学将B装置玻璃管内的残留物溶于水,对所得溶液中的阳离子提出以下假设并设计实验进行相关证明,完成横线上的内容,并将答案分别填入答题卡中甲、乙、丙、丁处.

(1)不加热条件下检查A装置气密性的操作方法是将管口a封闭,向分液漏斗中注入水,打开分液漏斗活塞,水的液面不会连续下降,证明装置A的气密性良好.
(2)制备开始时A装置烧瓶中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)按气流方向连接完整装置:a→h→i→d→e→b→c→f→g(按仪器接口字母编号)
(4)若无E装置可能产生的后果是未反应的氯气污染空气,空气中的水可使无水FeCl3水解.
(5)本实验合理的操作步骤为②③①④⑥⑤(按操作顺序选择序号).
①添加药品 ②连接仪器 ③检查装置气密性 ④点燃A处酒精灯
⑤点燃B处酒精灯 ⑥使B中硬质玻璃管内充满黄绿色气体
(6)实验完毕后该组同学将B装置玻璃管内的残留物溶于水,对所得溶液中的阳离子提出以下假设并设计实验进行相关证明,完成横线上的内容,并将答案分别填入答题卡中甲、乙、丙、丁处.
| 提出假设 | 加入试剂及操作 | 实验现象 | 得出结论 |
| 假设1:含Fe2+(甲) | 取少许溶液少许,先滴入KSCN溶液,然后再滴入几滴氯水(乙) | 溶液先无明显变化,后变为血红色 | 含该离子 |
| 假设2:含Fe3+ | 滴入几滴KSCN溶液 | 溶液变为血红色 | 含Fe3+ |
| 假设3:含Fe2+、Fe3+ | 取A、B两等份溶液少许,A加入少量高锰酸钾溶液(丙); B加入KSCN溶液 | A溶液紫色退为无色(丁),B溶液变为血红色 | 二者都存在 |
12. 如图,将新制的氯气通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛有的试剂不可能是( )
如图,将新制的氯气通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛有的试剂不可能是( )
 如图,将新制的氯气通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛有的试剂不可能是( )
如图,将新制的氯气通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛有的试剂不可能是( )| A. | 浓硫酸 | B. | NaOH溶液 | C. | Kl溶液 | D. | 饱和食盐水 |
9.一定条件下,H2O2在水溶液中发生分解反应:2H2O2$\frac{\underline{\;一定条件\;}}{\;}$2H2O+O2↑反应过程中,测得不同时间H2O2的物质的量浓度如表:
(1)H2O2的分解反应是氧化还原反应(填“是”或“不是”).
(2)该分解反应0─40min的平均反应速率v(H2O2)为0.015mol•L-1 min-1.
(3)若有1mol H2O2 反应时,转移了1mol电子.
| t/min | 0 | 20 | 40 | 60 | 80 |
| c(H2O2)/mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(2)该分解反应0─40min的平均反应速率v(H2O2)为0.015mol•L-1 min-1.
(3)若有1mol H2O2 反应时,转移了1mol电子.
16.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论错误的是( )
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中加入Na2CO3粉末,有气泡产生,说明氯水中含有H+ | |
| C. | 向KI溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO | |
| D. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
6.下列物质分类合理的是( )
| A. | 氧化物:CO | B. | 酸:NaHSO4 | C. | 碱:纯碱 | D. | 铵盐:NH3•H2O |
13.下列说法不正确的是( )
| A. | 石油分馏后得到的汽油、柴油、煤油等都是纯净物 | |
| B. | “静电除尘”、“燃煤固硫”、“汽车尾气催化净化”才能提高空气质量 | |
| C. | 太阳能电池板中的硅元素在元素周期表中处于金属与非金属的交界位置 | |
| D. | 煤经过气化和液化两个物理变化,可变为清洁能源 |
10.钠元素在周期表中的位置是( )
| A. | 第二周期ⅣA族 | B. | 第三周期IA族 | C. | 第三周期ⅥA族 | D. | 第二周期ⅥA族 |
11.下列说法中,不正确的是( )
| A. | 乙醇与金属钠反应时,是乙醇分子中羟基中的O-H键断裂 | |
| B. | 检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水 | |
| C. | 禁止用工业酒精配制饮用酒和调味用的料酒 | |
| D. | 溴乙烷、TNT、葡萄糖都是无色溶于水的有机化合物 |