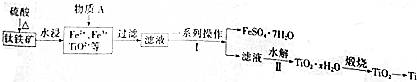
题目内容
20.为确定某种抗酸药-碱式碳酸铝镁[MgaAlb(OH)c(CO3)d]的组成,进行如下实验:Ⅰ、向一定量样品中加入过量盐酸,产生气体A.
Ⅱ、向Ⅰ中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤.
Ⅲ、向沉淀B中加过量NaOH溶液,沉淀全部溶解.
Ⅳ、向Ⅱ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C.
已知:Al3+在pH=5.0时沉淀完全:Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全.且有n(A):n(B):n(C)=2:2:3,则该碱式碳酸铝镁的化学式为( )
| A. | Mg2Al2(OH)4(CO3)3 | B. | Mg3Al2(OH)6(CO3)2 | C. | Mg3Al(OH)3(CO3)3 | D. | Mg3Al2(OH)8(CO3)2 |
分析 I.加入过量的盐酸,反应本质为:OH-+H+=H2O、CO32-+2H+=CO2↑+H2O,气体A为CO2;Ⅱ.向I所得的溶液中加入氨水,调节pH至5~6,得到白色沉淀B为Al(OH)3;Ⅲ.向沉淀B中加过量NaOH溶液,沉淀全部溶解转化为NaAlO2;Ⅳ.向Ⅱ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C为Mg(OH)2,根据n(A):n(B):n(C)=2:2:3确定d、b、a的值,再根据电荷守恒确定c的值,进而确定化学式.
解答 解:I.加入过量的盐酸,反应本质为:OH-+H+=H2O、CO32-+2H+=CO2↑+H2O,气体A为CO2;Ⅱ.向I所得的溶液中加入氨水,调节pH至5~6,得到白色沉淀B为Al(OH)3;Ⅲ.向沉淀B中加过量NaOH溶液,沉淀全部溶解转化为NaAlO2;Ⅳ.向Ⅱ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C为Mg(OH)2,根据n(A):n(B):n(C)=2:2:3,可知d=2、b=2、a=3,根据电荷守恒可知c=$\frac{2×3+3×2-2×2}{1}$=8,故该物质化学式为:Mg3Al2(OH)8(CO3)2,
故选:D.
点评 本题考查物质组成的测定等,题目涉及反应较多,过程复杂,为易错题目,明确各阶段发生的反应是解题关键,注意守恒思想的运用.

练习册系列答案
相关题目
16.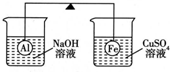 在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如下图所示.下列说法正确的是( )
在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如下图所示.下列说法正确的是( )
 在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如下图所示.下列说法正确的是( )
在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如下图所示.下列说法正确的是( )| A. | 铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡 | |
| B. | 铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,溶液蓝色变浅,杠杆右边下沉 | |
| C. | 反应后去掉两烧杯,杠杆仍平衡 | |
| D. | 右边球上出现红色,左边溶液的碱性增强 |
11.(一)某课外实验活动小组拟用下列装置和药品制备无水氯化铁晶体,该物质极易潮解,100℃左右时升华,完成下列问题:
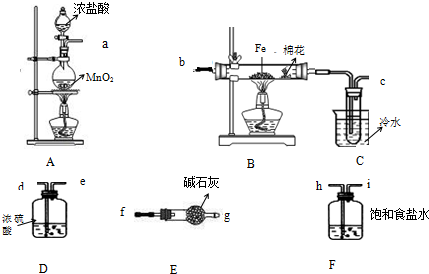
(1)不加热条件下检查A装置气密性的操作方法是将管口a封闭,向分液漏斗中注入水,打开分液漏斗活塞,水的液面不会连续下降,证明装置A的气密性良好.
(2)制备开始时A装置烧瓶中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)按气流方向连接完整装置:a→h→i→d→e→b→c→f→g(按仪器接口字母编号)
(4)若无E装置可能产生的后果是未反应的氯气污染空气,空气中的水可使无水FeCl3水解.
(5)本实验合理的操作步骤为②③①④⑥⑤(按操作顺序选择序号).
①添加药品 ②连接仪器 ③检查装置气密性 ④点燃A处酒精灯
⑤点燃B处酒精灯 ⑥使B中硬质玻璃管内充满黄绿色气体
(6)实验完毕后该组同学将B装置玻璃管内的残留物溶于水,对所得溶液中的阳离子提出以下假设并设计实验进行相关证明,完成横线上的内容,并将答案分别填入答题卡中甲、乙、丙、丁处.

(1)不加热条件下检查A装置气密性的操作方法是将管口a封闭,向分液漏斗中注入水,打开分液漏斗活塞,水的液面不会连续下降,证明装置A的气密性良好.
(2)制备开始时A装置烧瓶中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)按气流方向连接完整装置:a→h→i→d→e→b→c→f→g(按仪器接口字母编号)
(4)若无E装置可能产生的后果是未反应的氯气污染空气,空气中的水可使无水FeCl3水解.
(5)本实验合理的操作步骤为②③①④⑥⑤(按操作顺序选择序号).
①添加药品 ②连接仪器 ③检查装置气密性 ④点燃A处酒精灯
⑤点燃B处酒精灯 ⑥使B中硬质玻璃管内充满黄绿色气体
(6)实验完毕后该组同学将B装置玻璃管内的残留物溶于水,对所得溶液中的阳离子提出以下假设并设计实验进行相关证明,完成横线上的内容,并将答案分别填入答题卡中甲、乙、丙、丁处.
| 提出假设 | 加入试剂及操作 | 实验现象 | 得出结论 |
| 假设1:含Fe2+(甲) | 取少许溶液少许,先滴入KSCN溶液,然后再滴入几滴氯水(乙) | 溶液先无明显变化,后变为血红色 | 含该离子 |
| 假设2:含Fe3+ | 滴入几滴KSCN溶液 | 溶液变为血红色 | 含Fe3+ |
| 假设3:含Fe2+、Fe3+ | 取A、B两等份溶液少许,A加入少量高锰酸钾溶液(丙); B加入KSCN溶液 | A溶液紫色退为无色(丁),B溶液变为血红色 | 二者都存在 |
8.下列化学用语表示正确的是( )
| A. | Mg2+的结构示意图: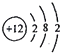 | |
| B. | 乙酸的结构简式:CH3CH2OH | |
| C. | 硫酸钾的电离方程式:K2SO4═K2++SO${\;}_{4}^{2-}$ | |
| D. | CO2的电子式: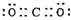 |
15.在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | NH3$→_{催化剂,△}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$发烟硝酸 | |
| B. | Al2O3$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{△}{→}$无水AlCl3$→_{熔融}^{电解}$Al | |
| C. | CuSO4(aq)$\stackrel{NaOH(aq)}{→}$Cu(OH)2悬浊液$→_{△}^{蔗糖}$Cu2O | |
| D. | SiO2$→_{高温}^{Na_{2}CO_{3}}$Na2SiO3$\stackrel{盐酸}{→}$硅酸凝胶 |
12. 如图,将新制的氯气通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛有的试剂不可能是( )
如图,将新制的氯气通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛有的试剂不可能是( )
 如图,将新制的氯气通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛有的试剂不可能是( )
如图,将新制的氯气通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色.则甲装置中所盛有的试剂不可能是( )| A. | 浓硫酸 | B. | NaOH溶液 | C. | Kl溶液 | D. | 饱和食盐水 |
9.一定条件下,H2O2在水溶液中发生分解反应:2H2O2$\frac{\underline{\;一定条件\;}}{\;}$2H2O+O2↑反应过程中,测得不同时间H2O2的物质的量浓度如表:
(1)H2O2的分解反应是氧化还原反应(填“是”或“不是”).
(2)该分解反应0─40min的平均反应速率v(H2O2)为0.015mol•L-1 min-1.
(3)若有1mol H2O2 反应时,转移了1mol电子.
| t/min | 0 | 20 | 40 | 60 | 80 |
| c(H2O2)/mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
(2)该分解反应0─40min的平均反应速率v(H2O2)为0.015mol•L-1 min-1.
(3)若有1mol H2O2 反应时,转移了1mol电子.
10.钠元素在周期表中的位置是( )
| A. | 第二周期ⅣA族 | B. | 第三周期IA族 | C. | 第三周期ⅥA族 | D. | 第二周期ⅥA族 |