题目内容
2.下列说法正确的是( )| A. | 难溶于水的BaCO3是弱电解质 | |
| B. | 0.1mol/L的CH3COOH溶液中H+浓度为0.1mol/L | |
| C. | 强电解质水溶液的导电能力一定比弱电解质的强 | |
| D. | 电解质溶液导电的原因是溶液中有自由移动的阴、阳离子 |
分析 A.电解质是水溶液中或熔融状态下导电的化合物,水溶液中完全电离的电解质为强电解质,水溶液中部分电离的电解质为弱电解质;
B.醋酸属于弱酸,溶液中不能全部电离,存在电离平衡;
C.溶液导电性强弱取决于离子浓度的大小,离子浓度越大溶液导电性越强;
D.溶液导电是带电离子的定向移动产生电流,溶液导电的原因是溶液中有自由移动的阴阳离子;
解答 解:A.难溶于水的BaCO3是盐,水溶液中溶解性小,电离出的离子浓度很小,溶液不能导电,但在熔融状态下能完全电离,属于强电解质,故A错误;
B.0.1mol/L的CH3COOH溶液中,醋酸存在电离平衡,不能全部电离出醋酸分子中的氢离子,所以溶液中的H+浓度小于0.1mol/L,故B错误;
C.溶液导电性强弱取决于离子浓度的大小,和电解质强弱无直接关系,浓的弱电解质溶液导电性可以强于极稀的强电解质溶液导电性,故C错误;
D.电解质溶液导电的原因是溶液中有自由移动的阴阳离子,通电时离子定向移动形成电流,故D正确;
故选D.
点评 本题考查了电解质电离、强电解质和弱电解质概念的分析判断,注意弱电解质电离平衡的分析和溶液导电的实质理解,题目难度中等.

练习册系列答案
相关题目
10.下列说法中正确的是( )
| A. | 中子数为18的氯原子可表示为18Cl | |
| B. | 盐酸和食醋既是化合物又是酸 | |
| C. | 可以通过过滤的方法将淀粉胶体中混有的氯化钠溶液除去 | |
| D. | 6.8g熔融KHSO4与3.9g熔融Na2O2中阴离子数目相同 |
17.在焊接铜器时,可用NH4Cl溶液除去铜器表面的氧化铜,其反应为:CuO+NH4Cl═Cu+CuCl2+N2↑+H2O(未配平).下列有关该反应的说法正确的是( )
| A. | 被氧化和被还原的元素分别为铜和氮 | |
| B. | 当产生0.2mol气体时,转移电子为0.6mol | |
| C. | 被还原的CuO占参与反应CuO的$\frac{1}{2}$ | |
| D. | 参加反应的氧化剂和还原剂的物质的量之比为3:2 |
7.下列叙述不正确的是( )
| A. | 溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3>NaHCO3 | |
| C. | 与足量稀盐酸反应:Na2CO3比NaHCO3更剧烈 | |
| D. | 等质量的Na2CO3和NaHCO3分别与足量稀盐酸反应:Na2CO3放出的CO2更多 |
14.常温下,浓度均为0.1mol•L-1的4种钠盐溶液pH如下:
下列说法中不正确的是( )
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
| A. | 四种溶液中,Na2CO3溶液中水的电离程度最大 | |
| B. | 向氯水中加入NaHCO3(s),可以增大氯水中次氯酸的浓度 | |
| C. | NaHSO3溶液显酸性的原因是:NaHSO3═Na++H++SO32- | |
| D. | 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最小的是H2SO3 |
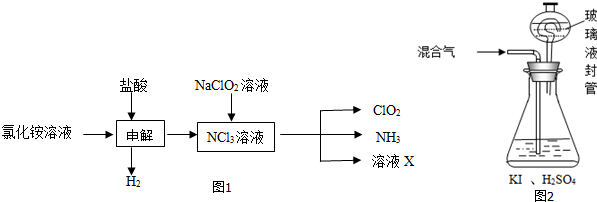
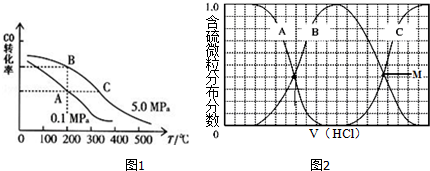
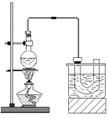 实验室制备溴乙烷(C2H5Br)的装置和步骤如下:(已知溴乙烷的沸点38.4℃)①检查装置的气密性,向装置图所示的∪形管和大烧杯中加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小心加热,使其充分反应.回答下列问题:
实验室制备溴乙烷(C2H5Br)的装置和步骤如下:(已知溴乙烷的沸点38.4℃)①检查装置的气密性,向装置图所示的∪形管和大烧杯中加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小心加热,使其充分反应.回答下列问题: