题目内容
9.下列叙述不正确的是( )| A. | 明矾可作净水剂,向海水中加入明矾可以使海水淡化 | |
| B. | 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜 | |
| C. | 臭氧是一种氧化性较强的气体,可用于自来水的消毒 | |
| D. | SO2具有还原性,可用已知浓度的KMnO4溶液测定食品中SO2残留量 |
分析 A.向海水中加入净水剂明矾只能除去悬浮物杂质;
B.氯碱工业中阴极氢离子放电,则阳离子需要移动到阴极;
C.臭氧均有强氧化性能杀菌消毒;
D.二氧化硫能与高锰酸钾反应,反应中高锰酸钾会褪色.
解答 解:A.向海水中加入净水剂明矾只能除去悬浮物杂质,但不能使海水淡化,应用蒸馏的方法得到淡水,故A错误;
B.氯碱工业中阴极氢离子放电,则需要阳离子交换膜使钠离子移动到阴极,钠离子与氢氧根离子结合生成NaOH,故B正确;
C.臭氧均有强氧化性能杀菌消毒,所以可用于自来水的消毒,故C正确;
D.二氧化硫能与高锰酸钾反应,反应中高锰酸钾会褪色,所以根据溶液褪色判断滴定终点,因此可用已知浓度的KMnO4溶液测定食品中SO2残留量,故D正确.
故选A.
点评 本题考查化学在生产生活中的应用,把握电解原理、化学反应原理及应用、物质性质及应用为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
19.下列结论正确的是( )
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K.
| A. | ②③⑤⑦ | B. | ②⑥⑦ | C. | ②④⑤⑥⑦ | D. | ②④⑥ |
17.下列有关实验的叙述对应关系不正确的是( )
| 选项 | A | B | C | D |
| 装 置 图 |  | 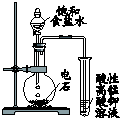 | 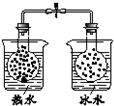 |  |
| 现 象 | 导管中液面上升 | KMnO4溶液褪色 | 热水中的NO2球红棕色加深 | 白色沉淀逐渐转化为黄色沉淀 |
| 结 论 | 该条件下,铁钉发生吸氧腐蚀 | 电石和水反应生成乙炔 | 2NO2(g)?N2O4(g)△H<0 | Ksp:AgCl>AgI |
| A. | A | B. | B | C. | C | D. | D |
4.下列叙述均正确且前后有因果关系的是( )
| A. | 常温,NaHCO3溶解度比Na2CO3小,向饱和Na2CO3溶液中通入CO2产生沉淀 | |
| B. | 常温,SiO2与氢氟酸、NaOH溶液均可反应,SiO2是两性氧化物 | |
| C. | BaSO3难溶于水,SO2气体通入Ba(NO3)2溶液中产生沉淀 | |
| D. | 非金属性:Cl>S,酸性:HClO>H2SO4 |
14.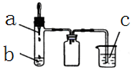 利用如图所示装置进行下列实验,实验现象与结论均正确的是( )
利用如图所示装置进行下列实验,实验现象与结论均正确的是( )
 利用如图所示装置进行下列实验,实验现象与结论均正确的是( )
利用如图所示装置进行下列实验,实验现象与结论均正确的是( )| 选项 | 实验试剂 | 实验现象 | 实验结论 | ||
| a | b | c | |||
| A | 浓氨水 | 碱石灰 | FeCl2溶液 | 产生白色沉淀,迅速变为灰绿色,最后变为红褐色 | 氨气具有氧化性 |
| B | 稀硫酸 | FeS | AgCl悬浊液 | 悬浊液由白色变为黑色 | Ksp(AgCl)>Ksp(Ag2S) |
| C | 浓硝酸 | 铜 | BaSO3悬浊液 | 悬浊液变澄清 | +4价硫具有还原性 |
| D | 浓盐酸 | KMnO4 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
2.表给出了14种元素的电负性.
已知:两成键元素间电负性差值大于1.7时,形成离子键;两成键元素间电负性差值小于1.7时,形成共价键.
(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是在同一周期中,随着原子序数的递增,元素的电负性逐渐增大,并呈周期性变化;.
(2)判断下列物质是离子化合物还是共价化合物.
Mg3N2:离子化合物;BeCl2:共价化合物;AlCl3:共价化合物;SiC:共价化合物.
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
(1)根据表中给出的数据,可推知元素的电负性具有的变化规律是在同一周期中,随着原子序数的递增,元素的电负性逐渐增大,并呈周期性变化;.
(2)判断下列物质是离子化合物还是共价化合物.
Mg3N2:离子化合物;BeCl2:共价化合物;AlCl3:共价化合物;SiC:共价化合物.
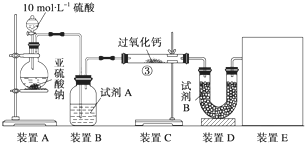
 CO(g)+3H2(g)△H=-(a+b-3C)kJ.mol-1.
CO(g)+3H2(g)△H=-(a+b-3C)kJ.mol-1.
 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们可以用如图所示的装置制取乙酸乙酯:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们可以用如图所示的装置制取乙酸乙酯: