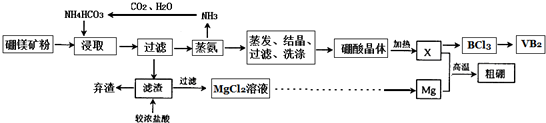
题目内容
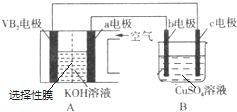
17.下列有关实验的叙述对应关系不正确的是( )| 选项 | A | B | C | D |
| 装 置 图 |  | 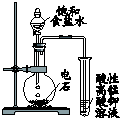 | 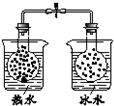 |  |
| 现 象 | 导管中液面上升 | KMnO4溶液褪色 | 热水中的NO2球红棕色加深 | 白色沉淀逐渐转化为黄色沉淀 |
| 结 论 | 该条件下,铁钉发生吸氧腐蚀 | 电石和水反应生成乙炔 | 2NO2(g)?N2O4(g)△H<0 | Ksp:AgCl>AgI |
| A. | A | B. | B | C. | C | D. | D |
分析 A.食盐水为中性,Fe发生吸氧腐蚀;
B.生成的乙炔及混有的硫化物均能被高锰酸钾氧化;
C.热水中的NO2球红棕色加深,可知升高温度,平衡向生成二氧化氮的方向移动;
D.发生沉淀的转化.
解答 解:A.食盐水为中性,Fe发生吸氧腐蚀,则导管中液面上升,故A正确;
B.生成的乙炔及混有的硫化物均能被高锰酸钾氧化,不能验证乙炔的生成,应选硫酸铜溶液除去硫化物,再利用高锰酸钾检验,故B错误;
C.热水中的NO2球红棕色加深,可知升高温度,平衡向生成二氧化氮的方向移动,则2NO2(g)?N2O4(g)△H<0,故C正确;
D.发生沉淀的转化,向溶度积小的方向移动,则白色沉淀逐渐转化为黄色沉淀,可知Ksp:AgCl>AgI,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握原电池应用、有机物的结构与性质、温度对化学平衡的影响、沉淀转化等为解答的关键,侧重分析与实验能力的考查,注意化学反应原理及实验装置的作用,题目难度不大.

练习册系列答案
相关题目
7.有A、B、C、D、E、F六种短周期元素,已知A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如右图所示.F的单质可与酸反应,1mol F单质与足量酸反应能产生33.6L H2(标准状况);F的阳离子与A的阴离子核外电子排布完全相同.回答下列问题:
(1)C在周期表中的位置为第三周期第ⅥA族.
(2)元素D的+1价含氧酸的电子式为 .A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.
.A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.
(3)向D与F形成的化合物的水溶液中加入过量氨水,有关反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
| E | A | |||
| B | C | D |
(2)元素D的+1价含氧酸的电子式为
 .A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.
.A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.(3)向D与F形成的化合物的水溶液中加入过量氨水,有关反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
12.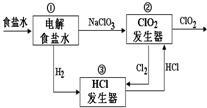 利用食盐水制取ClO2的工业流程如图所示.
利用食盐水制取ClO2的工业流程如图所示.
装置①中的反应:NaCl+3H2O$\stackrel{通直流电}{→}$NaClO3+3H2↑
装置②中的反应:2NaClO3+4HCl→2ClO2+Cl2↑+2NaCl+2H2O
下列关于该流程的说法正确的是( )
 利用食盐水制取ClO2的工业流程如图所示.
利用食盐水制取ClO2的工业流程如图所示.装置①中的反应:NaCl+3H2O$\stackrel{通直流电}{→}$NaClO3+3H2↑
装置②中的反应:2NaClO3+4HCl→2ClO2+Cl2↑+2NaCl+2H2O
下列关于该流程的说法正确的是( )
| A. | 该流程中仅NaCl可循环利用 | |
| B. | 装置①中H2是阴极产物 | |
| C. | 装置②中Cl2是还原产物 | |
| D. | 为使H2完全转化为HCl,还应向装置③中再补充Cl2 |
9.下列叙述不正确的是( )
| A. | 明矾可作净水剂,向海水中加入明矾可以使海水淡化 | |
| B. | 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜 | |
| C. | 臭氧是一种氧化性较强的气体,可用于自来水的消毒 | |
| D. | SO2具有还原性,可用已知浓度的KMnO4溶液测定食品中SO2残留量 |

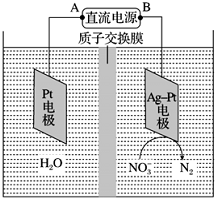 电化学降解NO3-的原理如图所示.
电化学降解NO3-的原理如图所示. 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得: