题目内容
17.下列物质一定表示一种纯净物的是( )| A. | C5H12 | B. | C4H10 | C. |  | D. | CHCl3 |
分析 纯净物是由一种物质组成的物质,混合物是由多种物质组成的物质;据此结合常见物质的组成成分以及同分异构体的概念判断解答.
解答 解:A.C5H12存在同分异构体,可表示CH3CH2CH2CH2CH3为正戊烷,去掉拿下1个碳原子作为支链: 为异戊烷,去掉2个碳原子作为支链:
为异戊烷,去掉2个碳原子作为支链: 为新戊烷,所以C5H12表示的不物质不一定是纯净物,故A错误;
为新戊烷,所以C5H12表示的不物质不一定是纯净物,故A错误;
B.C4H10 存在同分异构体,可表示正丁烷或者是异丁烷,所以C4H10 表示的不物质不一定是纯净物,故B错误;
C.乙烯发生加聚反应生成聚乙烯,由于聚合度n不同,故聚乙烯为混合物,故C错误;
D.化学式为CHCl3的物质只有一种结构是一氯甲烷结构,不存在同分异构体,一定是纯净物,故D正确;
故选D.
点评 本题考查了纯净物的判断,熟悉纯净物、混合物的概念,掌握同分异构体、同素异形体的判断是解题关键,题目难度不大.

练习册系列答案
相关题目
7.我国科学家首次合成了一种过渡金属的新核素${\;}_{72}^{185}$Hf,其单质有延展性、不易被腐蚀等特点,可应用于高科技领域.185Hf可由180Hf转化而成,下列有关180Hf、185Hf说法正确的是( )
| A. | 180Hf转化为185Hf是化学变化 | |
| B. | 二者的核外电子数分别为108、113 | |
| C. | 1mol 180Hf的中子数比1mol 185Hf少5NA | |
| D. | 在元素周期表中的位置不同 |
8.根据有机化合物的命名原则,下列命名正确的是( )
| A. |  3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 | |
| B. |  2-羟基丁烷 2-羟基丁烷 | |
| C. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | |
| D. | CH3CH(CH3)CH2COOH 3-甲基丁酸 |
12.目前含有元素硒(Se)的保健品已开始涌入市场,已知它与氧同主族,而与钙同周期,下列关于硒的有关描述中不正确的是( )
| A. | 原子序数为24 | |
| B. | 最高价氧化物为SeO3,为酸性氧化物 | |
| C. | 原子半径比钙小 | |
| D. | 气态氢化物分子式为H2Se,性质不稳定 |
9.下列实验操作中正确的是( )
| A. | 蒸馏实验中,温度计水银球应位于蒸馏烧瓶中液面以下 | |
| B. | 制备乙酸乙酯的实验中,导管末端要伸入饱和Na2CO3溶液液面下 | |
| C. | 分液操作中,待下层液体流出后,将上层液体从分液漏斗上口倒出 | |
| D. | 测定溶液pH时,可用pH试纸蘸取少量待测液并与标准比色卡比较 |
6. 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如表对比实验:
(l)请完成以下实验设计表1(表中不要留空格)
表1
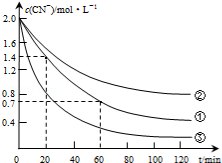
实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示.
(2)实验①中20~60min时间段反应速率:υ(CN-)=0.0175mol•L-1•min-1.
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化)(填一点即可).在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成表2中内容.(己知:废水中的CN-浓度可用离子色谱仪测定)
表2
 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如表对比实验:
(l)请完成以下实验设计表1(表中不要留空格)
表1
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
(2)实验①中20~60min时间段反应速率:υ(CN-)=0.0175mol•L-1•min-1.
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化)(填一点即可).在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成表2中内容.(己知:废水中的CN-浓度可用离子色谱仪测定)
表2
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
7.下列除去杂质的实验方法不正确的是( )
| A. | 除去CO2中少量HCl气体:通过饱和NaHCO3溶液后再干燥气体 | |
| B. | 除去Na2CO3固体中少量NaHCO3:置于坩埚中加热 | |
| C. | 除去氧化铝中混有的少量二氧化硅,用足量的稀盐酸溶解后过滤 | |
| D. | 除去FeCl3酸性溶液中少量的FeCl2:通入稍过量的Cl2 |
 化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳,而氢气被认为是无碳无污染的清洁能源.
化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳,而氢气被认为是无碳无污染的清洁能源.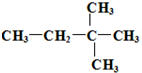 由另一种烃D通过加成反应而制得,则烃D的可能的是
由另一种烃D通过加成反应而制得,则烃D的可能的是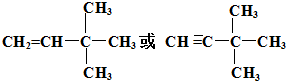 (任写一种可能的结构简式)
(任写一种可能的结构简式)