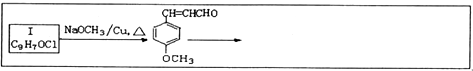
题目内容
13.向amolKOH的溶液中通入bmolSO2,下列说法不正确的是( )| A. | 当a>2b时,发生的离子反应为:2OH-+SO2=SO32-+H2O | |
| B. | 当a<b时,发生的离子反应为:OH-+SO2=HSO3- | |
| C. | 当2a=3b时,发生的离子反应为:3OH-+2SO2=SO32-+HSO3-+H2O | |
| D. | 当0.5a<b<a时,溶液中HSO3-与SO32-的物质的量之比为(a-b):(2b-a) |
分析 向amolKOH的溶液中通入bmolSO2,当a≥2b时,KOH溶液过量,反应生成硫酸钠和水,反应的离子方程式为:2OH-+SO2=SO32-+H2O;当a≤b时,二氧化硫过量,反应生成亚硫酸氢钠,反应的离子方程式为:OH-+SO2=HSO3-,据此结合过量情况分析.
解答 解:A.当a>2b时,氢氧化钾过量,反应生成亚硫酸钠和水,发生的离子反应为:2OH-+SO2=SO32-+H2O,故A正确;
B.当a<b时,二氧化硫过量,反应生成亚硫酸氢钠,发生的离子反应为:OH-+SO2=HSO3-,故B正确;
C.当2a=3b时,二者恰好反应生成等量的亚硫酸钠和亚硫酸氢钠,发生的离子反应为:3OH-+2SO2=SO32-+HSO3-+H2O,故C正确;
D.当0.5a<b<a时,KOH部分过量,反应生成亚硫酸钠和亚硫酸氢钠,bmolKOH消耗bmol二氧化硫生成bmol亚硫酸氢钠,氢氧化钾剩余(a-b)mol,(a-b)molKOH继续与(a-b)mol硫酸氢钾反应生成(a-b)mol硫酸钾,剩余的硫酸氢钾的物质的量为:bmol-(a-b)mol=(2b-a)mol,所以溶液中HSO3-与SO32-的物质的量之比为(2b-a):(a-b),故D错误;
故选D.
点评 本题考查了离子方程式的书写,题目难度中等,根据反应物过量情况正确判断生成物为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.在一定温度下,向某固定容积的密闭容器中加入1mol N2和3mol H2,发生如下反应:N2(g)+3H2(g)?2NH3(g).此反应达到平衡状态的标志是( )
| A. | 容器内气体密度不再发生变化 | |
| B. | 容器内各物质的浓度不再发生变化 | |
| C. | v正(H2)=v逆(NH3) | |
| D. | 单位时间消耗0.1mol N2的同时生成0.2mol NH3 |
1.下列属于氧化还原反应的是( )
| A. | Na2O+H2O═2NaOH | B. | Cl2+H2O═HCl+HClO | ||
| C. | H2SO4+Na2SO3=Na2SO4+SO2↑+H2O | D. | FeS+2HCl═FeCl2+H2S↑ |
8.放热的可逆反应在一定条件下达到化学平衡时,下列说法不正确的是( )
| A. | 反应物的浓度一定等于生成物的浓度 | |
| B. | 反应体系中压强恒定 | |
| C. | 反应体系中混合物的组成保持不变 | |
| D. | 反应体系中温度不变 |
5.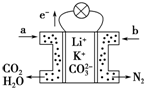 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以C4H10为燃料时,该电池工作原理如图.下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以C4H10为燃料时,该电池工作原理如图.下列说法正确的是( )
 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以C4H10为燃料时,该电池工作原理如图.下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以C4H10为燃料时,该电池工作原理如图.下列说法正确的是( )| A. | a为C4H10,b为CO2 | |
| B. | 在熔融电解质中,CO32-向正极移动 | |
| C. | 此电池在常温时也能工作 | |
| D. | 通入丁烷的一极是负极,电极反应为:C4H10-26e-+13CO32-=17CO2↑+5H2O |
2.下列各组物质中,都属于混合物的是( )
| A. | 石灰水、水 | B. | 干冰、冰水混合物 | ||
| C. | 石墨、铁矿石 | D. | 不锈钢菜刀、食用醋 |
9.当固体AgCl放在较浓的KI溶液中振荡时,则部分AgCl转化为AgI,原因是( )
| A. | AgI比AgCl稳定 | B. | 碘氧化性比氯弱 | ||
| C. | I-的还原性比Cl-强 | D. | 溶解度AgI<AgCl |


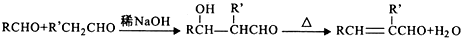
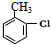 ,H→I两步反应的反应类型加成反应、消去反应.
,H→I两步反应的反应类型加成反应、消去反应.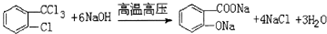 ,E→F
,E→F