题目内容
14.日常生活中遇到的很多问题都涉及到化学知识,下列有关叙述正确的是( )| A. | 在涂料中尽量用液态有机物代替水作溶剂,以减少环境污染 | |
| B. | 我国自行研制的“神七”航天服是由新型“连续纤维增韧”材料做成的,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 | |
| C. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| D. | 醋酸纤维、硝化纤维、合成纤维、光导纤维都可由纤维素在一定条件下制得 |
分析 A.根据液态有机物对人体有害,污染环境;
B.碳化硅陶瓷和碳纤维由非金属元素组成;
C.过分开发可燃冰,会影响海洋生态环境;
D.光导纤维为二氧化硅.
解答 解:A.在涂料中用液态有机物代替水作溶剂,有机物溶剂多为有毒物质,如苯、甲苯等对人体有害,容易造成环境污染,故A错误;
B.碳化硅陶瓷和碳纤维由非金属元素组成,为新型无机非金属材料,故B正确;
C.过分开发可燃冰,会影响海洋生态环境,故C错误;
D.光导纤维为二氧化硅,不能用纤维素制得,故D错误;
故选:B.
点评 本题考查了化学与生产、生活联系密切的有关知识,涉及环境污染、新能源的开发与利用、材料的分类和用途,题目难度不大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
4.下列各组化合物中,化学键类型完全相同的是( )
| A. | CH4,H2O2,NH3 | B. | H2O,CO2,Na2O2 | C. | Na2O,NaCl,MgCl2 | D. | NaOH,NaClO,Na2O |
5.资料显示:
a.Na2S2O3、BaS2O3、BaS均易溶于水.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究:
实验制备装置如图所示(省略夹持装置):
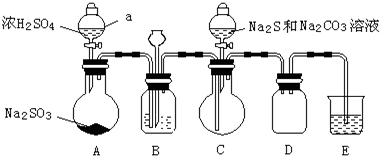
回答问题:
(1)装置A中发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(2)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是观察B的气泡流速,旋转A分液漏斗活塞,通过控制硫酸流量而控制SO2流量.
(3)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是排除装置内空气,防止发生氧化生成Na2SO4.
③结束反应后,取C中溶液,经蒸发、结晶、过滤、洗涤、干燥、得到Na2S2O3?5H2O.
(4)完成对所得产品的检测的实验:
a.Na2S2O3、BaS2O3、BaS均易溶于水.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究:
实验制备装置如图所示(省略夹持装置):

回答问题:
(1)装置A中发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(2)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是观察B的气泡流速,旋转A分液漏斗活塞,通过控制硫酸流量而控制SO2流量.
(3)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是排除装置内空气,防止发生氧化生成Na2SO4.
③结束反应后,取C中溶液,经蒸发、结晶、过滤、洗涤、干燥、得到Na2S2O3?5H2O.
(4)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S、Na2CO3 Na2SO4 及 Na2SO3 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3, 一定不含有Na2S、Na2SO4. |
2.表是元素周期表的一部分,下列说法正确的是( )
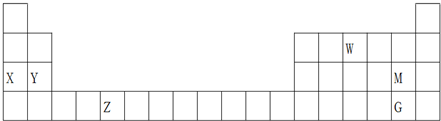

| A. | 最高价氧化物的水化物的碱性:X<Y | |
| B. | W的氢化物的球棍模型为: | |
| C. | 酸性:HMO4<HGO4 | |
| D. | Z的某些化合物可以用作反应的催化剂 |
19.设NA是阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4LNO和NH3的混合气体中,所含氮原子数为2NA | |
| B. | 1molFe粉与1mol水蒸气充分反应转移的电子数为3NA | |
| C. | 某温度下10LpH=11的NaOH溶液中含OH-的数目为NA,该温度下纯水的pH=6 | |
| D. | 含有阴、阳离子总数为1.5NA的NaHSO3溶液,浓度为0.5mol•L-1 |
6.10g甲物质和7g乙物质恰好完全反应,生成4.4g丙物质、1.8g丁物质和0.1mol戊物质,则戊物质的摩尔质量为( )
| A. | 100g•mol-1 | B. | 108g•mol-1 | C. | 55g•mol-1 | D. | 96g•mol-1 |
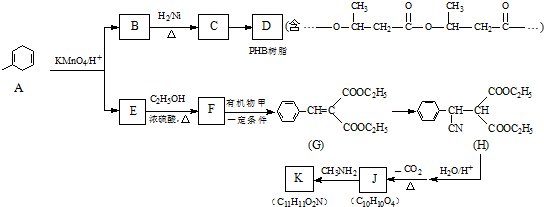
3. 1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠.反应原理为:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠.反应原理为:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
 1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠.反应原理为:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠.反应原理为:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )| A. | 电解熔融氢氧化钠制钠,阳极发生的电极反应为:2OH--2e-═H2↑+O2↑ | |
| B. | 盖•吕萨克法制钠证明铁的还原性比钠强 | |
| C. | 若用戴维法与盖•吕萨克法制得等量的钠,则两反应各自转移的电子数相同 | |
| D. | 电解熔融氯化钠制钠的电解槽中(如上图),石墨为阳极,铁为阴极 |
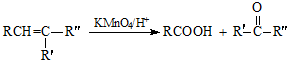
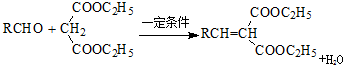
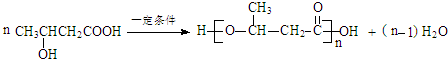 :.
:. .
.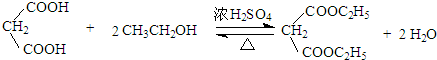 .
.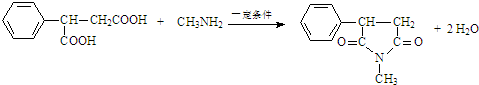 .
.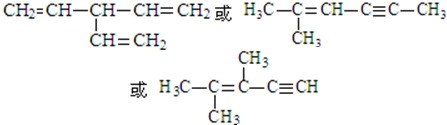 .
. 利用如图所示的装置和其他必要的仪器用品,完成下列实验.
利用如图所示的装置和其他必要的仪器用品,完成下列实验.