题目内容
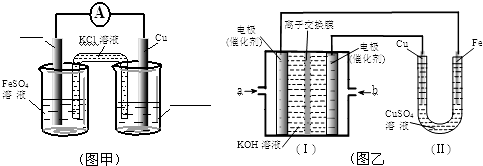
4. 利用如图所示的装置和其他必要的仪器用品,完成下列实验.
利用如图所示的装置和其他必要的仪器用品,完成下列实验.已知2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O,该实验证明氨气具有还原性.
(1)碱石灰的作用是吸收水蒸气,倒扣漏斗的作用是防止倒吸.
(2)浓氨水与固体NaOH接触,会逸出大量氨气原因是NaOH吸水放热,使溶液温度升高,有利于NH3•H2O分解,且c(OH-)增大,使NH3+H2O?NH4++OH-平衡左移,也有利于氨气的逸出.
(3)硬质玻璃管中可观察到的实验现象是黑色粉末变为红色,有无色液滴产生.
(4)常温下,若氨水与稀硫酸恰好完全中和,则所得溶液中各离子浓度的大小顺序为c(NH4+)>c(SO42-)>c(H+)>c(OH-).
分析 由实验装置可知,浓氨水与NaOH反应生成氨气,碱石灰干燥氨气后,大试管中发生2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O,观察到黑色变为红色,有无色液体生成,且氨气易溶液硫酸,倒扣的漏斗可防止倒吸,以此来解答.
解答 解:(1)制取的氨气中含有水蒸气,氨气与氧化铜反应需要加热,所以氨气进入硬质试管前应进行干燥,所以碱石灰作用为干燥氨气,氨气极易溶于硫酸,倒扣的漏斗球形部分空间大,可防止倒吸,
故答案为:吸收水蒸气;防止倒吸;
(2)氧化钙与水反应放出热量,使氨气在水中溶解度降低而逸出,溶液中氢氧根离子浓度增大,使平衡NH3+H2O?NH3•H2O?NH4++OH-,逆向移动,有利于氨气逸出,
故答案为:NaOH吸水放热,使溶液温度升高,有利于NH3•H2O分解,且c(OH-)增大,使NH3+H2O?NH4++OH-平衡左移,也有利于氨气的逸出;
(3)硬质玻璃管中发生的反应2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O,氧化铜为黑色、铜为红色,所以可观察到的实验现象是黑色粉末变为红色,有无色液滴产生,
故答案为:黑色粉末变为红色,有无色液滴产生;
(4)1mol硫酸铵,含有2mol铵根离子,1mol硫酸根离子,铵根离子部分水解,则溶液显示酸性:c(H+)>c(OH-),铵根离子水解程度较小、硫酸根离子不水解,则c (NH4+)>c(SO42-)>c(H+),则溶液中各离子的浓度由大到小的顺序为:c (NH4+)>c(SO42-)>c(H+)>c(OH-),
故答案为:(NH4+)>c(SO42-)>c(H+)>c(OH-).
点评 本题考查性质实验方案的设计,为高频考点,把握氨气的制备实验原理、性质实验、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意水解原理的应用,题目难度不大.

| A. | 在涂料中尽量用液态有机物代替水作溶剂,以减少环境污染 | |
| B. | 我国自行研制的“神七”航天服是由新型“连续纤维增韧”材料做成的,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 | |
| C. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| D. | 醋酸纤维、硝化纤维、合成纤维、光导纤维都可由纤维素在一定条件下制得 |
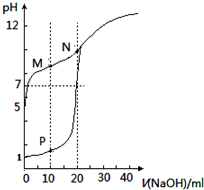
| A. | 滴定时均可用酚酞作指示剂 | |
| B. | M点c(HX)-c(X-)>c(OH-)-c(H+) | |
| C. | 将P点和N点的溶液混合,$\frac{{K}_{W}}{c({H}^{+})}$<1.0×10-7mol/L | |
| D. | 向N点的溶液中通入HCl至pH=7:c(Na+)>c(HX)=c(Cl-) |
| A. | AlCl3溶液中加入NaOH溶液 | B. | AlCl3溶液中加入足量的氨水 | ||
| C. | AlCl3溶液中加入石灰水 | D. | Al2O3溶于足量的热水中 |
| A. | 80% | B. | 大于80% | C. | 小于80% | D. | 无法计算 |