题目内容
5.资料显示:a.Na2S2O3、BaS2O3、BaS均易溶于水.
b.SO2、Na2S、Na2CO3反应可生成Na2S2O3.
某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究:
实验制备装置如图所示(省略夹持装置):
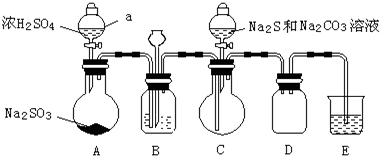
回答问题:
(1)装置A中发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(2)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是观察B的气泡流速,旋转A分液漏斗活塞,通过控制硫酸流量而控制SO2流量.
(3)在装置C中生成Na2S2O3.
①完成反应方程式:4SO2+2Na2S+1Na2CO3=3Na2S2O3+CO2
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是排除装置内空气,防止发生氧化生成Na2SO4.
③结束反应后,取C中溶液,经蒸发、结晶、过滤、洗涤、干燥、得到Na2S2O3?5H2O.
(4)完成对所得产品的检测的实验:
| 推测 | 操作和现象 | 结论 |
| 杂质中的正盐成分可能有: Na2S、Na2CO3 Na2SO4 及 Na2SO3 | ①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生. | 产品杂质中: 一定含有Na2SO3, 可能含有Na2CO3, 一定不含有Na2S、Na2SO4. |
分析 浓硫酸与亚硫酸钠反应生成二氧化硫和硫酸钠:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,装置B用于观察通入二氧化硫的生成速率,可以用亚硫酸氢钠溶液;在装置C中发生反应4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2,从而制备出Na2S2O3;二氧化硫有毒,装置E为尾气吸收装置,
(1)装置A中浓硫酸与亚硫酸钠反应生成二氧化硫和硫酸钠,据此写出反应的化学方程式;
(2)①装置B中所盛放的液体应不能够与二氧化硫反应;
②如使SO2缓慢进入烧瓶C,应使A中缓慢反应;
(3)①据得失电子守恒和原子守恒配平化学方程式;
②先使C中充满二氧化硫,C中才能反应;
(4)①取Wg产品配成稀溶液;
②向溶液中滴加过量BaCl2溶液,有白色沉淀生成,说明杂志可能有Na2CO3、Na2SO3、Na2SO4,
③向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生,说明没有Na2SO4,一定有Na2SO3,可能有Na2CO3.
解答 解:浓硫酸与亚硫酸钠反应生成二氧化硫和硫酸钠:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,装置B用于观察通入二氧化硫的生成速率,可以用亚硫酸氢钠溶液;在装置C中发生反应4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2,从而制备出Na2S2O3;二氧化硫有毒,装置E为尾气吸收装置,
(1)浓硫酸与亚硫酸钠反应生成二氧化硫和硫酸钠,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)①装置B中所盛放的液体应不能够与二氧化硫反应,二氧化硫能够溶于水,能够与亚硫酸钠和碳酸氢钠溶液反应,
故答案为:c;
②如使SO2缓慢进入烧瓶C,应使A中缓慢反应,可观察B的气泡流速,旋转A分液漏斗活塞,通过控制硫酸流量而控制SO2流量,
故答案为:观察B的气泡流速,旋转A分液漏斗活塞,通过控制硫酸流量而控制SO2流量;
(3)①S元素在二氧化硫中为+4价,在硫化钠中为-2价,反应后为+2价,所以二氧化硫和硫化钠物质的量之比为2:1,据原子守恒,二氧化硫钱的化学计量数为4,硫化钠的化学计量数为2,据原子守恒,还生成二氧化碳,化学方程式为:4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2,
故答案为:4;2;1;3;CO2;
②反应开始先使A中发生反应一会儿,再使C中反应发生,目的是排除装置内空气,先使C中充满二氧化硫,防止发生氧化生成Na2SO4,
故答案为:排除装置内空气,防止发生氧化生成Na2SO4;
(4)向溶液中滴加过量BaCl2溶液,有白色沉淀生成,说明杂质可能有Na2CO3、Na2SO3、Na2SO4,向沉淀中加入过量盐酸,沉淀完全溶解,并有刺激性气味的气体产生,说明没有Na2SO4、Na2S,一定有Na2SO3,可能有Na2CO3,排除Na2S的原因是Na2S和Na2SO3在酸性条件下会生成淡黄色的S沉淀,
故答案为:
| 推测 | 操作和现象 | 结论 |
| Na2SO3 Na2CO3 Na2S、Na2SO4 |
点评 本题以制备硫代硫酸钠晶体(Na2S2O3•5H2O)为载体,考查了制备方案的设计,题目难度中等,涉及氧化还原反应方程式书写、配平以及物质的分离提纯、检验、设计优化等知识,试题知识点较多、综合性较强,充分考查了学生的灵活应用能力.

 科学实验活动册系列答案
科学实验活动册系列答案| A. | 84消毒液具有碱性,可用作消毒剂和漂白剂 | |
| B. | 氢氟酸具有酸性,可用于玻璃的腐蚀剂 | |
| C. | 过氧化钠具有漂白性,可作航空和潜水的供氧剂 | |
| D. | 活性铁粉具有还原性,在食品袋中可用作除氧剂 |
| A. | v(O2)=0.01 mol/(L•s) | B. | v(NO)=0.08 mol/(L•s) | ||
| C. | v(H2O)=0.003 mol/(L•s) | D. | v(NH3)=0.001 mol/(L•s) |
| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2$\frac{\underline{\;100℃\;}}{\;}$ SO2↑+Cl2↑ |
| H2SO4 | 10.4 | 338 | 吸水性且不易分解 |

(1)仪器A冷却水的进水口为a(填“a”或“b”).
(2)仪器B中盛放的药品是碱石灰.
(3)实验时,装置丁中发生反应的离子方程式为ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(4)装置丙的作用为除去Cl2中的HCl,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为SO2Cl2+2H2O═H2SO4+2HCl.
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H═H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸.
①从分解产物中分离出硫酰氯的方法是蒸馏.
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):取产物在干燥条件下加热至完全反应(或挥发或分解等),冷却后加水稀释;取少量溶液滴加紫色石蕊试液变红;再取少量溶液,加入BaCl2溶液产生白色沉淀,说明含有H2SO4.或取反应后的产物直接加BCl2溶液,有白色沉淀,再滴加紫色石蕊试液变红,说明含有H2SO4.
| A. | 放电时正极附近溶液的碱性增强 | |
| B. | 充电时锌极与外电源正极相连 | |
| C. | 放电时每转移3 mol电子,正极有1mol K2FeO4被还原 | |
| D. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO42-+4 H2O |
| A. | 在涂料中尽量用液态有机物代替水作溶剂,以减少环境污染 | |
| B. | 我国自行研制的“神七”航天服是由新型“连续纤维增韧”材料做成的,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 | |
| C. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| D. | 醋酸纤维、硝化纤维、合成纤维、光导纤维都可由纤维素在一定条件下制得 |
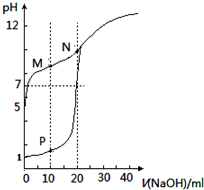
| A. | 滴定时均可用酚酞作指示剂 | |
| B. | M点c(HX)-c(X-)>c(OH-)-c(H+) | |
| C. | 将P点和N点的溶液混合,$\frac{{K}_{W}}{c({H}^{+})}$<1.0×10-7mol/L | |
| D. | 向N点的溶液中通入HCl至pH=7:c(Na+)>c(HX)=c(Cl-) |