题目内容
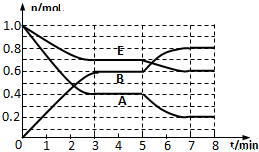 在一体积为2L的密闭容器中,气态物质A、B、E的物质的量n随时间t的变化如图所示.已知达到平衡后,降低温度A的转化率增大.
在一体积为2L的密闭容器中,气态物质A、B、E的物质的量n随时间t的变化如图所示.已知达到平衡后,降低温度A的转化率增大.(1)写出此反应的化学方程式
(2)根据图数据,从反应开始到第一次达到平衡时平均速率v (E)为
(3)在5~7min内曲线变化的原因可能是
A.降低了温度 B.使用了催化剂 C.减小了容器的体积 D.减少了A的物质的量
(4)设该反应达到平衡时的平衡常数为K1,保持温度不变,将容器体积减少一半,达到新的平衡后,测得B的平衡浓度为原来的2.2倍,平衡常数为K2,则
A.平衡向正反应方向移动,且K2 >K1
B.平衡移动过程中,正反应速率大于逆反应速率.
C.达到新平衡时,A的浓度增大,且K1 >K2
D.达到新平衡时,E的浓度是原来的2倍多,且K1 =K2.
考点:物质的量或浓度随时间的变化曲线,化学平衡常数的含义,化学平衡的影响因素
专题:化学平衡专题
分析:(1)根据图象知,A和E是反应物、B是生成物,达到平衡状态时△n(A)=(1.0-0.4)mol=0.6mol、△n(B)=(0.6-0)mol=0.6mol、△n(E)=(1.0-0.7)mol=0.3mol,同一可逆反应反应中,同一时间段内各物质物质的量变化量之比等于其计量数之比,据此书写反映方程式;
降低温度,A的转化率增大,说明平衡向正反应方向移动,降低温度平衡向放热反应方向移动;
(2)平均速率v (E)=
;
(3)在5~7min内,B物质的量增大、E物质的量减小、A物质的量减小,说明平衡向正反应方向移动,
改变条件的瞬间,各物质的物质的量不变,由温度、压强、催化剂、浓度对平衡移动的影响分析判断;
(4)设该反应达到平衡时的平衡常数为K1,保持温度不变,化学平衡常数不变,将容器体积减少一半,假设平衡不移动,B的浓度应该是原来的2倍,实际上是原来的2.2倍,说明平衡向正反应方向移动.
降低温度,A的转化率增大,说明平衡向正反应方向移动,降低温度平衡向放热反应方向移动;
(2)平均速率v (E)=
| ||
| △t |
(3)在5~7min内,B物质的量增大、E物质的量减小、A物质的量减小,说明平衡向正反应方向移动,
改变条件的瞬间,各物质的物质的量不变,由温度、压强、催化剂、浓度对平衡移动的影响分析判断;
(4)设该反应达到平衡时的平衡常数为K1,保持温度不变,化学平衡常数不变,将容器体积减少一半,假设平衡不移动,B的浓度应该是原来的2倍,实际上是原来的2.2倍,说明平衡向正反应方向移动.
解答:
解:(1)根据图象知,A和E是反应物、B是生成物,达到平衡状态时△n(A)=(1.0-0.4)mol=0.6mol、△n(B)=(0.6-0)mol=0.6mol、△n(E)=(1.0-0.7)mol=0.3mol,同一可逆反应反应中,同一时间段内各物质物质的量变化量之比等于其计量数之比,所以A、E、B的计量数之比=0.6mol:0.3mol:0.6mol=2:1:2,则该反应方程式为2A(g)+E(g)?2B(g);
降低温度,A的转化率增大,说明平衡向正反应方向移动,降低温度平衡向放热反应方向移动,所以正反应是放热反应,
故答案为:2A(g)+E(g)?2B(g);放;
(2)平均速率v (E)=
=
=0.05mol/(L.min),
故答案为:0.05mol/(L.min);
(3)在5~7min内,B物质的量增大、E物质的量减小、A物质的量减小,说明平衡向正反应方向移动,
改变条件的瞬间,各物质的物质的量不变,v′(E)=
=
=0.025mol/(L.min)<0.05mol/(L.min),反应速率减小,
A.降低了温度反应速率减小,平衡向正反应方向移动,符合条件,故正确;
B.使用了催化剂反应速率增大且平衡不移动,不符合条件,故错误;
C.减小了容器的体积,改变条件的瞬间,各物质的物质的量浓度增大,与题干不符合,故错误;
D.减少了A的物质的量瞬间,物质的量曲线与原来平衡没有接触点,与题干不符合,故错误;
故选A;
(4)设该反应达到平衡时的平衡常数为K1,保持温度不变,化学平衡常数不变,将容器体积减少一半,假设平衡不移动,B的浓度应该是原来的2倍,实际上是原来的2.2倍,说明平衡向正反应方向移动,
A.平衡向正反应方向移动,温度不变,所以平衡常数不变,所以K2 =K1,故错误;
B.平衡向正反应方向移动,所以移动过程中,正反应速率大于逆反应速率,故正确;
C.因为体积减小,则A的浓度增大,平衡向正反应方向移动,但A转化的量小于浓度增大的量,达到新平衡时,A的浓度增大,温度不变,平衡常数不变,所以K1 =K2,故错误;
D.因为体积减小为原来的一半,假设平衡不移动,E的浓度是原来的2倍,实际上平衡向正反应方向移动,则达到新平衡时,E的浓度小于原来的2倍,温度不变,平衡常数不变,所以K1 =K2,故错误;
故选B.
降低温度,A的转化率增大,说明平衡向正反应方向移动,降低温度平衡向放热反应方向移动,所以正反应是放热反应,
故答案为:2A(g)+E(g)?2B(g);放;
(2)平均速率v (E)=
| ||
| △t |
| ||
| 3min |
故答案为:0.05mol/(L.min);
(3)在5~7min内,B物质的量增大、E物质的量减小、A物质的量减小,说明平衡向正反应方向移动,
改变条件的瞬间,各物质的物质的量不变,v′(E)=
| ||
| △t |
| ||
| 2 |
A.降低了温度反应速率减小,平衡向正反应方向移动,符合条件,故正确;
B.使用了催化剂反应速率增大且平衡不移动,不符合条件,故错误;
C.减小了容器的体积,改变条件的瞬间,各物质的物质的量浓度增大,与题干不符合,故错误;
D.减少了A的物质的量瞬间,物质的量曲线与原来平衡没有接触点,与题干不符合,故错误;
故选A;
(4)设该反应达到平衡时的平衡常数为K1,保持温度不变,化学平衡常数不变,将容器体积减少一半,假设平衡不移动,B的浓度应该是原来的2倍,实际上是原来的2.2倍,说明平衡向正反应方向移动,
A.平衡向正反应方向移动,温度不变,所以平衡常数不变,所以K2 =K1,故错误;
B.平衡向正反应方向移动,所以移动过程中,正反应速率大于逆反应速率,故正确;
C.因为体积减小,则A的浓度增大,平衡向正反应方向移动,但A转化的量小于浓度增大的量,达到新平衡时,A的浓度增大,温度不变,平衡常数不变,所以K1 =K2,故错误;
D.因为体积减小为原来的一半,假设平衡不移动,E的浓度是原来的2倍,实际上平衡向正反应方向移动,则达到新平衡时,E的浓度小于原来的2倍,温度不变,平衡常数不变,所以K1 =K2,故错误;
故选B.
点评:本题考查物质的量或浓度随时间变化曲线,侧重考查计算,明确外界条件对平衡的影响是解本题关键,注意平衡常数只与温度有关,与物质浓度无关,为易错点.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、14g乙烯和丁烯的混合物中含有的原子总数为3NA个 |
| B、标准状况下,22.4L己烷中共价键数目为19NA |
C、1mol苯乙烯( 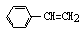 )中含有的C=C数为4NA )中含有的C=C数为4NA |
| D、7g CnH2n中含有的氢原子数目为2NA |
a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物的水化物显碱性,且碱性b>a,c和d的气态氢化物的热稳定性c>d,五种元素的原子,得失电子后所形成的简单离子中,e的离子半径最小,则它们的原子序数由小到大的顺序是( )
| A、b、a、e、d、c |
| B、e、b、a、d、c |
| C、b、a、d、c、e |
| D、c、d、e、a、b |
根据部分短周期元素的原子半径及主要化合价信息,下列判断正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、氢化物的沸点为H2T<H2R |
| B、单质分别与稀盐酸反应的速率:L<Q |
| C、L、M和R为同周期元素 |
| D、L2+与R2-的核外电子数相等 |
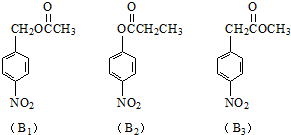
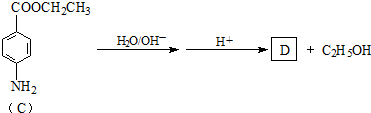
 ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.
ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.