题目内容
根据部分短周期元素的原子半径及主要化合价信息,下列判断正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、氢化物的沸点为H2T<H2R |
| B、单质分别与稀盐酸反应的速率:L<Q |
| C、L、M和R为同周期元素 |
| D、L2+与R2-的核外电子数相等 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期元素中,元素最高正化合价与其族序数相等,其最低负化合价=族序数-8,同一周期元素,其原子半径随着原子序数增大而减小,同一主族元素,其原子半径随着原子序数增大而增大,根据表中信息知,L、Q属于第IIA族元素,原子半径L>Q,则L是Mg元素、Q是Be元素;
M为第IIIA族元素,M原子半径大于Q而小于L,则M为Al元素;
R、T为第VIA族元素,R原子半径大于T,则R是S元素、T是O元素,
再结合物质性质、元素周期律解答.
M为第IIIA族元素,M原子半径大于Q而小于L,则M为Al元素;
R、T为第VIA族元素,R原子半径大于T,则R是S元素、T是O元素,
再结合物质性质、元素周期律解答.
解答:
解:短周期元素中,元素最高正化合价与其族序数相等,其最低负化合价=族序数-8,同一周期元素,其原子半径随着原子序数增大而减小,同一主族元素,其原子半径随着原子序数增大而增大,根据表中信息知,L、Q属于第IIA族元素,原子半径L>Q,则L是Mg元素、Q是Be元素;
M为第IIIA族元素,M原子半径大于Q而小于L,则M为Al元素;
R、T为第VIA族元素,R原子半径大于T,则R是S元素、T是O元素,
A.T是O元素、R是S元素,水中含有氢键、硫化氢中不含氢键,氢键的存在导致氢化物沸点升高,所以氢化物的沸点H2T>H2R,即H2O>H2S,故A错误;
B.L是Mg元素、Q是Be元素,同一主族金属的金属性随着原子序数增大而增大,所以金属性Mg>Be,则与稀盐酸的反应速率Mg>Be,即L>Q,故B错误;
C.L是Mg元素、M是Al元素、R是S元素,三种元素都位于第三周期,故C正确;
D.Mg2+核外有10个电子、S2-核外有18个电子,所以二者核外电子数不等,故D错误;
故选C.
M为第IIIA族元素,M原子半径大于Q而小于L,则M为Al元素;
R、T为第VIA族元素,R原子半径大于T,则R是S元素、T是O元素,
A.T是O元素、R是S元素,水中含有氢键、硫化氢中不含氢键,氢键的存在导致氢化物沸点升高,所以氢化物的沸点H2T>H2R,即H2O>H2S,故A错误;
B.L是Mg元素、Q是Be元素,同一主族金属的金属性随着原子序数增大而增大,所以金属性Mg>Be,则与稀盐酸的反应速率Mg>Be,即L>Q,故B错误;
C.L是Mg元素、M是Al元素、R是S元素,三种元素都位于第三周期,故C正确;
D.Mg2+核外有10个电子、S2-核外有18个电子,所以二者核外电子数不等,故D错误;
故选C.
点评:本题考查原子半径、元素化合价等元素周期律,明确原子半径变化规律、元素化合价与其族序数的关系是解本题关键,熟练掌握元素周期律并灵活运用,题目难度不大.

练习册系列答案
相关题目
在相同的温度和压强下,4个容器中分别装有4种气体.已知各容器中的气体和容器的容积分别是a.CO2 10L;b.O2 20L;c.N2 40L;d.CH460L.则4个容器中气体的质量由大到小的顺序是( )
| A、a>b>c>d |
| B、b>a>d>c |
| C、c>d>b>a |
| D、d>c>a>b |
下列反应的离子方程式正确的是( )
| A、Mg(OH)2和稀硫酸反应:H++OH-=H2O |
| B、碳酸钡与稀盐酸反应:CO32-+2H+=CO2↑+H2O |
| C、澄清石灰水跟盐酸:H++OH-=H2O |
| D、硫酸溶液与氢氧化钡溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
设NA表示阿伏加德罗常数,下列说法中不正确的是( )
| A、0.5mol O3 和11.2L O2的体积一定相等 |
| B、5.6 gFe与足量的稀盐酸充分反应后,转移的电子数为0.2NA |
| C、标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| D、1L 0.1mol/L的醋酸溶液中H+数目为0.1 NA |
能与大量Fe3+共存的是( )
| A、Fe |
| B、S2- |
| C、Cu2+ |
| D、Cu |
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断正确的是( )
| 实验编号 | 起始浓度/(mol?L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A、实验①反应后的溶液中:c(A-)>c(K+)>c(OH-)>c(H+) | ||
B、实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=
| ||
| C、实验②反应后的溶液中:c(A-)+c(HA)<0.1 mol/L | ||
| D、实验②反应后的溶液中:c(K+)+c(OH-)=c(H+)+c(A-) |
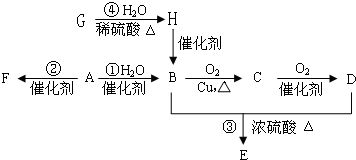
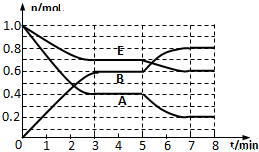 在一体积为2L的密闭容器中,气态物质A、B、E的物质的量n随时间t的变化如图所示.已知达到平衡后,降低温度A的转化率增大.
在一体积为2L的密闭容器中,气态物质A、B、E的物质的量n随时间t的变化如图所示.已知达到平衡后,降低温度A的转化率增大.