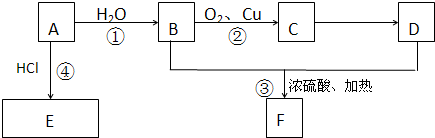
题目内容
a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物的水化物显碱性,且碱性b>a,c和d的气态氢化物的热稳定性c>d,五种元素的原子,得失电子后所形成的简单离子中,e的离子半径最小,则它们的原子序数由小到大的顺序是( )
| A、b、a、e、d、c |
| B、e、b、a、d、c |
| C、b、a、d、c、e |
| D、c、d、e、a、b |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:金属元素的最高价氧化物的水化物呈碱性,非金属元素的最高价氧化物的水化物呈酸性,元素的金属性越强其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,同一周期元素,元素的非金属性随着原子序数的增大而增强、金属性随着原子序数的增大而减弱,同一周期元素的离子半径随着原子序数的增大先减小后增大,据此分析解答.
解答:
解:金属元素的最高价氧化物的水化物呈碱性,非金属元素的最高价氧化物的水化物呈酸性,元素的金属性越强其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,同一周期元素,元素的非金属性随着原子序数的增大而增强、金属性随着原子序数的增大而减弱,同一周期元素的离子半径随着原子序数的增大先减小后增大,
a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物的水化物显碱性,则a、b都是金属,碱性b>a,则金属性b>a,原子序数a>b;
c和d有气态氢化物,则c、d都是非金属性,c、d的气态氢化物的热稳定性c>d,则非金属性c>d,原子序数c>d;
五种元素的原子,得失电子后所形成的简单离子中,e的离子半径最小,该元素属于金属元素且金属性较弱且没有非金属性,
所以这几种元素原子序数由小到大的顺序是b、a、e、d、c,故选A.
a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物的水化物显碱性,则a、b都是金属,碱性b>a,则金属性b>a,原子序数a>b;
c和d有气态氢化物,则c、d都是非金属性,c、d的气态氢化物的热稳定性c>d,则非金属性c>d,原子序数c>d;
五种元素的原子,得失电子后所形成的简单离子中,e的离子半径最小,该元素属于金属元素且金属性较弱且没有非金属性,
所以这几种元素原子序数由小到大的顺序是b、a、e、d、c,故选A.
点评:本题考查元素周期律,明确同一周期元素金属性、非金属性、金属性与其最高价氧化物的水化物碱性强弱关系、非金属性与其最高价氧化物的水化物酸性强弱关系等知识点即可解答,注意同一周期元素简单离子半径变化顺序,题目难度不大.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
将适量的物质分别加到干燥的红色布条上,不能使其褪色的是( )
| A、新制的氯水 |
| B、次氯酸钙溶液 |
| C、久置的氯水 |
| D、用盐酸酸化的次氯酸钠溶液 |
下列反应的离子方程式正确的是( )
| A、钠与水反应:Na+H2O=Na++OH-+H2↑ |
| B、氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| C、铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、氯化钡和稀硫酸反应:Ba2++SO42-=BaSO4↓ |
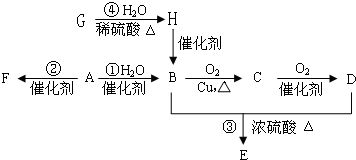
 现有部分前36号元素的性质或原子结构如下表:
现有部分前36号元素的性质或原子结构如下表: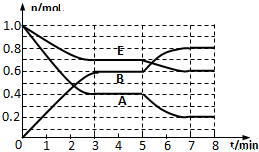 在一体积为2L的密闭容器中,气态物质A、B、E的物质的量n随时间t的变化如图所示.已知达到平衡后,降低温度A的转化率增大.
在一体积为2L的密闭容器中,气态物质A、B、E的物质的量n随时间t的变化如图所示.已知达到平衡后,降低温度A的转化率增大.