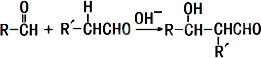题目内容
 ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.
ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题.(1)基态B原子核外电子排布式
(2)氯化铝(AlCl3)为无色透明晶体或白色而微带浅黄色的结晶性粉末,密度2.44g/cm3,熔点190℃(2.5大气压),沸点182.7℃,在177.8℃升华,氯化铝的蒸气或溶于非极性溶剂中或处于熔融状态时,都以共价的二聚成Al2Cl6形式存在,则氯化铝属于
(3)砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其中10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,砷化镓晶胞结构与金刚石相似.试回答下列问题:
①下列说法正确的是
A.砷化镓晶胞结构中Ga原子的轨道杂化方式为sp3
B.第一电离能:As<Ga
C.电负性:As<GaD.砷和镓都属于p区元素
②砷化镓是将(CH3)3Ga和AsH3用MOCVD方法制备得到,该反应在700℃进行,反应的方程式为
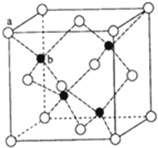
(4)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方ZnS晶体结构如图所示,其晶胞边长为540.0pm,密度为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:(1)B原子核外有5个电子,根据构造原理书写其基态原子核外电子排布式;根据价层电子对互斥理论确定B原子的杂化类型;
(2)分子晶体的熔沸点较低;
(3)①A.根据价层电子对互斥理论确定原子杂化类型;
B.同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素大于其相邻元素;
C.同一周期中,元素的电负性随着原子序数的增大而增大;
D.根据最后填入的电子判断其所属区名称;
②根据反应物、生成物和反应条件书写方程式;
(4)利用均摊法确定其化学式,结合ρ=
计算.
(2)分子晶体的熔沸点较低;
(3)①A.根据价层电子对互斥理论确定原子杂化类型;
B.同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素大于其相邻元素;
C.同一周期中,元素的电负性随着原子序数的增大而增大;
D.根据最后填入的电子判断其所属区名称;
②根据反应物、生成物和反应条件书写方程式;
(4)利用均摊法确定其化学式,结合ρ=
| m |
| V |
解答:
解:(1)B原子核外有5个电子,根据构造原理知基态B原子核外电子排布式为1s22s22p1,在BF3分子中中心原子B的价层电子对个数=3且不含孤电子对,所以B原子的轨道杂化方式为sp2,故答案为:1s22s22p1;sp2;
(2)分子晶体的熔沸点较低,根据氯化铝的熔沸点知,氯化铝属于分子晶体,故答案为:分子;
(3)①A.砷化镓中Ga原子的价层电子对个数是4且含有一个孤电子对,所以晶胞结构中Ga原子的轨道杂化方式为sp3,故A正确;
B.As和Ga属于同一周期元素,且As属于第VA族元素,所以第一电离能:As>Ga,故B错误;
C.电负性:As>Ga,故C错误;
D.砷和镓最后填入的电子都是p电子,所以都属于p区元素,故D正确;
故选AD;
②砷化镓是将(CH3)3Ga和AsH3用MOCVD方法制备得到,该反应在700℃进行,所以其方程式为(CH3)3Ga+AsH3
GaAs+3CH4,
故答案为:(CH3)3Ga+AsH3
GaAs+3CH4;
(4)该晶胞中S2-个数=8×
+6×
=4,Zn2+个数=4,所以该晶胞中Zn2+离子和S2-离子个数为4:4=1:1,所以其化学式为ZnS;
ρ=
=
g/cm3=4.1g/cm3,故答案为:4.1.
(2)分子晶体的熔沸点较低,根据氯化铝的熔沸点知,氯化铝属于分子晶体,故答案为:分子;
(3)①A.砷化镓中Ga原子的价层电子对个数是4且含有一个孤电子对,所以晶胞结构中Ga原子的轨道杂化方式为sp3,故A正确;
B.As和Ga属于同一周期元素,且As属于第VA族元素,所以第一电离能:As>Ga,故B错误;
C.电负性:As>Ga,故C错误;
D.砷和镓最后填入的电子都是p电子,所以都属于p区元素,故D正确;
故选AD;
②砷化镓是将(CH3)3Ga和AsH3用MOCVD方法制备得到,该反应在700℃进行,所以其方程式为(CH3)3Ga+AsH3
| ||
故答案为:(CH3)3Ga+AsH3
| ||
(4)该晶胞中S2-个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
ρ=
| m |
| V |
| ||
| 540×10-10 |
点评:本题考查了晶胞的计算、晶体类型的判断、化学式的判断、原子杂化方式的判断等知识点,根据均摊法确定化学式、根据价层电子对互斥理论确定原子杂化方式,结合元素周期律来分析解答,难点是晶胞密度的计算.

练习册系列答案
相关题目
下列物质中,不能和氯气发生取代反应的是( )
| A、CH3Cl |
| B、CCl4 |
| C、CH2Cl2 |
| D、CH4 |
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断正确的是( )
| 实验编号 | 起始浓度/(mol?L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A、实验①反应后的溶液中:c(A-)>c(K+)>c(OH-)>c(H+) | ||
B、实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=
| ||
| C、实验②反应后的溶液中:c(A-)+c(HA)<0.1 mol/L | ||
| D、实验②反应后的溶液中:c(K+)+c(OH-)=c(H+)+c(A-) |
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)?3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%.其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a%的是( )
| A、2molC |
| B、2 molA、1 molB和1 molHe(不参加反应) |
| C、1 molB和1 molC |
| D、2 molA、2 molB和3 molC |
 维生素C是一种水溶性维生素(其水溶液呈酸性),分子式为C6H8O6,结构如图所示.人体缺乏维生素C易得坏血病,所以维生素C又称抗坏血酸,维生素C易被空气中的氧气氧化.在新鲜的水果、蔬菜、乳制品中都含维生素C,如新鲜的橙汁中维生素C的含量在500mg?L-1左右.下列关于维生素C的叙述错误的是( )
维生素C是一种水溶性维生素(其水溶液呈酸性),分子式为C6H8O6,结构如图所示.人体缺乏维生素C易得坏血病,所以维生素C又称抗坏血酸,维生素C易被空气中的氧气氧化.在新鲜的水果、蔬菜、乳制品中都含维生素C,如新鲜的橙汁中维生素C的含量在500mg?L-1左右.下列关于维生素C的叙述错误的是( )| A、维生素C能使溴水褪色 |
| B、维生素C可作食品添加剂 |
| C、维生素C可发生酯化反应 |
| D、维生素C在碱性条件下能稳定存在 |
关于食物的酸碱性的说法正确的是( )
| A、食物中的主要成分能与酸反应的是碱性食物 |
| B、食物中的主要成分能与碱反应的是酸性食物 |
| C、食物在遇到甲基橙变红的是酸性食物,遇到酚酞变红的是碱性食物 |
| D、食物的酸碱性应当看食物在体内代谢完全后剩余物质的酸碱性 |
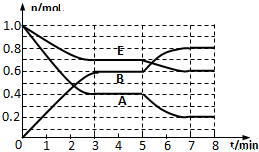 在一体积为2L的密闭容器中,气态物质A、B、E的物质的量n随时间t的变化如图所示.已知达到平衡后,降低温度A的转化率增大.
在一体积为2L的密闭容器中,气态物质A、B、E的物质的量n随时间t的变化如图所示.已知达到平衡后,降低温度A的转化率增大.