题目内容
1. 一定条件下,在体积为 3L 的密闭容器中反应 CO(g)+2H2(g)?CH3OH(g)△H=akJ•mol-1,△S=b J•mol-1•K-1(a、b 均为正数),达到化学平衡状态.
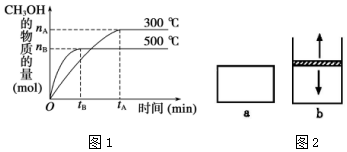
一定条件下,在体积为 3L 的密闭容器中反应 CO(g)+2H2(g)?CH3OH(g)△H=akJ•mol-1,△S=b J•mol-1•K-1(a、b 均为正数),达到化学平衡状态.(1)500℃时,从反应开始到达到化学平衡(图1),以 H2 的浓度变化表示的化学反应速率 是$\frac{2nB}{3tB}$(用 nB、tB 表示).
(2)判断该可逆反应达到化学平衡状态的标志是a、b、d(填字母).
a.2v 生成(CH3OH)=v 生成(H2) b.压强不变
c.混合气体的密度不再改变 d.CO 的体积分数不再变化
(3)如果反应从逆反应开始,将 CH3OH 充入容器 a 和 b 中进行反应(图2).a 的容积保持 不变,b 的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等.同温同压时,将等量的 CH3OH 充入初始体积相同的容器a、b中,反应同时开始.反应开始时,a 与 b中生成 H2的速率 vavb.反应过程中两容器里生成 H2 的速率是 va>vb. 达到平衡时,a 与 b 中 CH3OH 转化率相比较,则是αa<αb.
分析 (1)先根据图象计算甲醇的平均反应速率,同一时间内同一可逆反应中,各物质的反应速率之比等于其计量数之比;
(2)达到平衡时,正逆反应速率相等,混合气体的平均相对分子质量不再改变,CO、H2、CH3OH的浓度不再改变;
(3)(1)反应起始时,两容器中CH3OH的浓度相等;因为该反应是体积增大的反应,b是恒压,而a是恒容,所以在反应过程中a的压强大于b,压强大反应速率也大,再达到平衡时,a的压强大于b,b容器中反应正向进行的程度大于a,所以NO2的转化率大小关系是:αa<αb;
解答 解:(1)υ(CH3OH)=$\frac{n(B)}{nt×3L}$mol/(L.min),故υ(H2)=2υ(CH3OH)=$\frac{2nB}{3tB}$mol/(L.min),
故答案为:$\frac{2nB}{3tB}$mol/(L.min);
(2)2v 生成(CH3OH)=v 生成(H2),体现此时甲醇的正逆反应速率相等,达到平衡;两边的化学计量数和不等,压强不变是平衡状态;混合气体质量和体积始终不改变,气体的密度不变,不能作为判断是否达到平衡状态的依据;CO的浓度体积分数不再改变,说明达到平衡状态;
故答案为:a、b、d;
(3)反应起始时,两容器中甲醇的浓度相等,所以两容器中生成H2的速率关系是Va=Vb;因为该反应是体积增大的反应,b是恒压,而a是恒容,所以在反应过程中a的压强大于b,压强大反应速率也大,所以生成H2的速率关系是Va>Vb;因为该反应是体积增大的反应,b是恒压,而a是恒容,所以再达到平衡时,a的压强大于b,B容器中反应正向进行的程度大于A,所以甲醇的转化率大小关系是:αa<αb,
故答案为:等于;>;<.
点评 本题主要考查了反应速率的计算、平衡状态的判断及影响化学平衡移动的因素等知识点,难度不大,解的关键是要注意两容器一个是恒容一个恒压的区别.

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案| A. | 电子云表示电子在核外单位体积的空间出现的机会多少 | |
| B. | 同一原子处于激发态时的能量一定高于基态时的能量 | |
| C. | 各能级包含的原子轨道数按s、p、d、f的顺序依次为1、3、5、7 | |
| D. | 1个原子轨道里最多只能容纳2个电子,且自旋方向相同 |
 分子中在同一平面的碳原子数最多有( )
分子中在同一平面的碳原子数最多有( )| A. | 8 | B. | 9 | C. | 10 | D. | 11 |
| A. | 甲溶液含有OH- | B. | 乙溶液含有SO42- | C. | 丙溶液含有Cl- | D. | 丁溶液含有Mg2+ |

| A. | T1<T2,Q>0 | |
| B. | 增大压强,B的转化率减小 | |
| C. | 当混合气体的密度不再变化,反应达平衡状态 | |
| D. | a+b<c+d |
| A. | CO32-、Na+、K+ | B. | SO42-、Cl-、K+ | C. | Cl-、NO3-、K+ | D. | HCO3-、SO42-、K+ |
 氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.
氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.