题目内容
5.下列溶液中粒子的物质的量浓度关系正确的是( )| A. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-) | |
| B. | 20ml0.1mol/LCH3COONa溶液与10ml0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
分析 A.二者恰好完全反应生成碳酸钠和水,碳酸钠物质的量浓度为0.05mol/L,碳酸根离子水解导致溶液呈碱性,但其水解程度较小;
B.二者混合后溶液中溶质为等物质的量浓度的CH3COONa、NaCl、CH3COOH,混合溶液呈酸性,说明醋酸电离程度大于醋酸根离子水解程度;
C.室温下,pH=2的盐酸浓度小于pH=12的氨水浓度,二者等体积混合,氨水有剩余,溶液呈碱性,根据电荷守恒判断离子浓度大小;
D.二者恰好完全反应生成醋酸钠和水,醋酸钠水解导致溶液呈碱性,溶液中存在质子守恒,根据质子守恒判断.
解答 解:A.二者恰好完全反应生成碳酸钠和水,碳酸钠物质的量浓度为0.05mol/L,碳酸根离子水解导致溶液呈碱性,但其水解程度较小,钠离子不水解,水还电离生成氢氧根离子,所以离子浓度大小顺序是c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)故A错误;
B.二者混合后溶液中溶质为等物质的量浓度的CH3COONa、NaCl、CH3COOH,混合溶液呈酸性,说明醋酸电离程度大于醋酸根离子水解程度,氯离子不反应,所以离子浓度大小顺序是c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故B正确;
C.室温下,pH=2的盐酸浓度小于pH=12的氨水浓度,二者等体积混合,氨水有剩余,溶液呈碱性,根据电荷守恒得c(NH4+)>c(Cl-),一水合氨电离程度较小,所以离子浓度大小c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C正确;
D.二者恰好完全反应生成醋酸钠和水,醋酸钠水解导致溶液呈碱性,溶液中存在质子守恒,根据质子守恒得c(OH-)=c(H+)+c(CH3COOH),故D错误;
故选BC.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质成分及其性质是解本题关键,侧重考查学生分析判断能力,注意A中发生反应,易错选项是A.

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5k1•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)催化反应室中总反应的热化学方程式为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-246.1kJ•mol-1.
830℃时反应③的K=1.0,则在催化反应室中反应③的K>1.0(填“>”、“<”或“=”).
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L、c(H2)=2.4mol/L,5min后达到平衡、CO的转化率为50%,则5min内CO的平均反应速率为0.1mol/(L•min).
(3)反应②2CH3OH(g)═CH3OCH3(g)+H2O(g) 在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.64 | 0.50 | 0.50 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol•L-1.
(4)“二甲醚燃料电池”是一种绿色电源,其中工作原理如图所示.
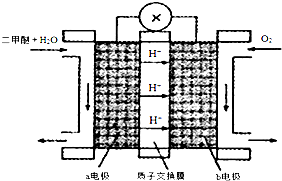
①该电池a电极上发生的电极反应式CH3OCH3+3H2O-12e-=2CO2+12H+.
②如果用该电池作为电解装置,当有23g二甲醚发生反应时,则理论上提供的电量表达式为0.5mol×12×1.6×10-19C×6.02×1023
mol-1C (1个电子的电量为1.6×10-19C).

| A. | T1<T2,Q>0 | |
| B. | 增大压强,B的转化率减小 | |
| C. | 当混合气体的密度不再变化,反应达平衡状态 | |
| D. | a+b<c+d |
Ⅰ、从海水中获取的粗盐除了含有泥沙外,还含有MgCl2、CaCl2、Na2SO4等可溶性杂质,精制时所用试剂为:A、盐酸;B、BaCl2溶液;C、NaOH溶液;D、Na2CO3溶液.加入试剂的顺序为BCDA或CBDA
Ⅱ、“mol”化学协会高二年级的同学设计了以下实验从海带中提取碘:
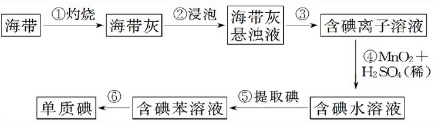
(1)、步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是BDF(从下列仪器中选出所需的仪器,用标号字母填写在空白处).
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)、步骤③的实验操作名称是过滤;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是萃取分液.
已知:
| 密度(g/cm3) | 熔点(.C) | 沸点(.C) | |
| 碘 | 4.93 | 113.5 | 184.35 |
| 苯 | 0.885 | 80.10 | 5.53 |
Ⅲ、湄潭自来水公司常用Cl2对自来水进行杀菌消毒,试设计实验检验自来水中是否含有Cl-取少量水样,加入硝酸银溶液,若生成白色沉淀,加稀硝酸沉淀不溶解,说明含有氯离子,则证明是Cl2对自来水进行杀菌消毒.
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 碳酸氢钠与盐酸反应:CO3-+2H+═H2O+CO2↑ | |
| C. | 醋酸溶液与氢氧化钠溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | 金属铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |

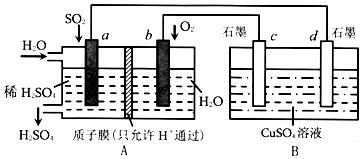
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义. 已知水的电离平衡曲线如图示,试回答下列问题:
已知水的电离平衡曲线如图示,试回答下列问题: