题目内容
下列各组溶液等体积混合后,所得溶液pH最大的是( )
| A、0.1mol?L-1NaHCO3溶液与0.1mol?L-1 NaOH溶液 |
| B、0.1mol?L-1NaHSO4溶液与0.1mol?L-1 Ba(OH)2溶液 |
| C、0.2mol?L-1氨水与0.1mol?L-1盐酸 |
| D、0.1mol?L-1氨水与0.1mol?L-1盐酸 |
考点:pH的简单计算
专题:
分析:首先判断溶液的酸碱性,碱溶液的pH大于酸溶液pH,然后比较溶液的氢离子或氢氧根离子浓度大小,以此解答该题.
解答:
解:A.0.1mol?L-1NaHCO3溶液与0.1mol?L-1 NaOH溶液混合,生成Na2CO3;
B.0.1mol?L-1NaHSO4溶液与0.1mol?L-1 Ba(OH)2溶液混合,Ba(OH)2过量,反应后c(OH-)=0.05mol/L;
C.0.2mol?L-1氨水与0.1mol?L-1盐酸混合,氨水过量,反应后氨水的浓度为0.05mol/L;
D.0.1mol?L-1氨水与0.1mol?L-1盐酸混合,反应生成氯化铵,水解呈酸性,
比较A、B、C可知,因一水合氨为弱电解质,B碱性最强,
故选B.
B.0.1mol?L-1NaHSO4溶液与0.1mol?L-1 Ba(OH)2溶液混合,Ba(OH)2过量,反应后c(OH-)=0.05mol/L;
C.0.2mol?L-1氨水与0.1mol?L-1盐酸混合,氨水过量,反应后氨水的浓度为0.05mol/L;
D.0.1mol?L-1氨水与0.1mol?L-1盐酸混合,反应生成氯化铵,水解呈酸性,
比较A、B、C可知,因一水合氨为弱电解质,B碱性最强,
故选B.
点评:本题考查溶液pH的比较,为高频考点,侧重学生的分析能力和计算能力的考查,注意把握盐类水解以及弱电解质的电离特点,难度不大.

练习册系列答案
相关题目
下列实验装置设计正确,且能达到目的是( )
A、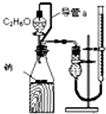 测定乙醇的结构式 |
B、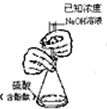 滴定法测定核酸的物质的量浓度 |
C、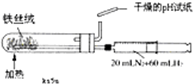 合成氨并检验氨的生成 |
D、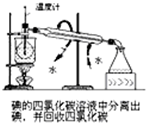 碘的四氯化碳溶液中分离出碘,并回收四氯化碳 |
海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法正确的是( )


| A、用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| B、制取NaHCO3的反应是利用其溶解度小于NaCl |
| C、在第③、④、⑤步骤中,溴元素均被氧化 |
| D、工业上通过电解饱和MgCl2溶液制取金属镁 |
工业上生产MnO2和Zn的主要反应有:①MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O②MnSO4+ZnSO4+2H2O
MnO2+Zn+2H2SO4下列说法不正确的是( )
| ||
| A、①中MnO2和H2SO4都是氧化剂 |
| B、MnSO4的还原性小于Zn的还原性 |
| C、②中MnSO4发生氧化反应 |
| D、硫酸在该生产中可循环利用 |
下列说法不正确的是( )
| A、糖类和蛋白质都能发生水解反应 |
| B、鸡蛋清和淀粉溶液可以用浓硝酸鉴别 |
| C、甲苯和乙酸在一定条件下都能发生取代反应 |
| D、植物油和石油的裂化产物均能使酸性KMnO4溶液褪色 |
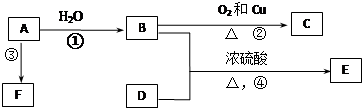 下列各有机物转化关系如图,A具有催热水果的作用;D能使石蕊试液变红;E是不溶于水的E是不溶于水且具有香味的无色液体,相对分子质量是C的2倍;F是高分子化合物,常用于制食品包装袋.结合如图关系回答问题:
下列各有机物转化关系如图,A具有催热水果的作用;D能使石蕊试液变红;E是不溶于水的E是不溶于水且具有香味的无色液体,相对分子质量是C的2倍;F是高分子化合物,常用于制食品包装袋.结合如图关系回答问题:
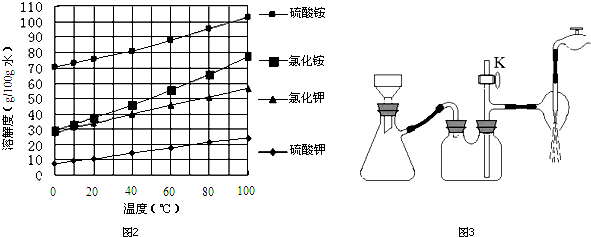
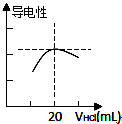 某学习小组利用中和反应原理测定某氨水的物质的量浓度,以测量溶液导电性判断滴定终点.实验步骤如下:
某学习小组利用中和反应原理测定某氨水的物质的量浓度,以测量溶液导电性判断滴定终点.实验步骤如下: