题目内容
欲除去下列各物质中的少量的杂质(括号内为杂质),将所需试剂或操作方法,实验现象或结论及有关反应的化学方程式填入下表.
| 混合物 | 试剂或操作方法 | 实验现象或结论 | 化学方程式 |
| NaOH溶液(Na2CO3) | |||
| Na2SO4溶液(NaHCO3) | |||
| NaHCO3溶液((Na2CO3) | |||
| Na2CO3固体(NaHCO3) | . |
考点:物质分离、提纯的实验方案设计,钠的重要化合物
专题:几种重要的金属及其化合物
分析:根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
NaOH混有Na2CO3,可加入氢氧化钡除杂,生成碳酸钡沉淀;
Na2SO4溶液混有NaHCO3,可加入硫酸除杂;
溶液中Na2CO3能与CO2、H2O反应生成NaHCO3,NaHCO3与CO2不反应,所以可用通入CO2来除杂;
NaHCO3不稳定,加热易分解,可用加热的方法除杂.
NaOH混有Na2CO3,可加入氢氧化钡除杂,生成碳酸钡沉淀;
Na2SO4溶液混有NaHCO3,可加入硫酸除杂;
溶液中Na2CO3能与CO2、H2O反应生成NaHCO3,NaHCO3与CO2不反应,所以可用通入CO2来除杂;
NaHCO3不稳定,加热易分解,可用加热的方法除杂.
解答:
解:NaOH混有Na2CO3,可加入氢氧化钡除杂,生成碳酸钡沉淀,方程式为Na2CO3+Ba(OH)2=2NaOH+BaCO3↓;
Na2SO4溶液混有NaHCO3,可加入硫酸除杂,生成二氧化碳气体,方程式为2NaHCO3+H2SO4=Na2SO4+CO2↑+H2O;
溶液中Na2CO3能与CO2、H2O反应生成NaHCO3,NaHCO3与CO2不反应,所以可用通入CO2来除杂,方程式为Na2CO3+H2O+CO2=2NaHCO3;
NaHCO3不稳定,加热易分解,可用加热的方法除杂,方程式为2NaHCO3
Na2CO3+H2O+CO2↑.
故答案为:
Na2SO4溶液混有NaHCO3,可加入硫酸除杂,生成二氧化碳气体,方程式为2NaHCO3+H2SO4=Na2SO4+CO2↑+H2O;
溶液中Na2CO3能与CO2、H2O反应生成NaHCO3,NaHCO3与CO2不反应,所以可用通入CO2来除杂,方程式为Na2CO3+H2O+CO2=2NaHCO3;
NaHCO3不稳定,加热易分解,可用加热的方法除杂,方程式为2NaHCO3
| ||
故答案为:
| 混合物 | 试剂或操作方法 | 实验现象或结论 | 化学方程式 | ||||
| NaOH溶液(Na2CO3) | 氢氧化钡 | 生成白色沉淀 | Na2CO3+Ba(OH)2=2NaOH+BaCO3↓ | ||||
| Na2SO4溶液(NaHCO3) | 硫酸 | 生成气体 | 2NaHCO3+H2SO4=Na2SO4+CO2↑+H2O | ||||
| NaHCO3溶液((Na2CO3) | 通入CO2 | 转化为NaHCO3 | Na2CO3+H2O+CO2=2NaHCO3 | ||||
| Na2CO3固体(NaHCO3) | 加热 | 分解,有气体生成 | 2NaHCO3
|
点评:本题考查物质的分离与除杂,为高考常见题型,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键,难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
设NA代表阿伏加德罗常数.下列说法正确的是( )
| A、2.9 g 2CaSO4?H2O中含有的结晶水分子数为0.02NA |
| B、30 g乙酸和葡萄糖的混和物中含碳原子数为NA |
| C、在铁与硫的反应中,1 mol铁失去的电子数为3NA |
| D、62 g Na2O溶于水后所得溶液中含有的O2-数为NA足量溶液A充分反应 |
下列实验装置设计正确,且能达到目的是( )
A、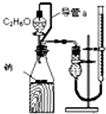 测定乙醇的结构式 |
B、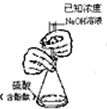 滴定法测定核酸的物质的量浓度 |
C、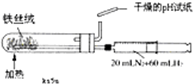 合成氨并检验氨的生成 |
D、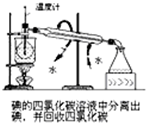 碘的四氯化碳溶液中分离出碘,并回收四氯化碳 |
工业上生产MnO2和Zn的主要反应有:①MnO2+ZnS+2H2SO4═MnSO4+ZnSO4+S+2H2O②MnSO4+ZnSO4+2H2O
MnO2+Zn+2H2SO4下列说法不正确的是( )
| ||
| A、①中MnO2和H2SO4都是氧化剂 |
| B、MnSO4的还原性小于Zn的还原性 |
| C、②中MnSO4发生氧化反应 |
| D、硫酸在该生产中可循环利用 |
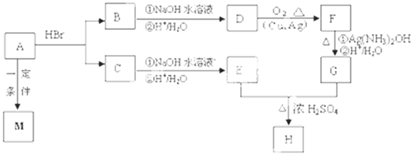
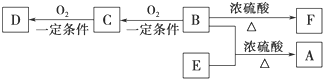
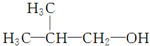 )和甲酸在一定条件下制取E.该反应的化学方程式是
)和甲酸在一定条件下制取E.该反应的化学方程式是
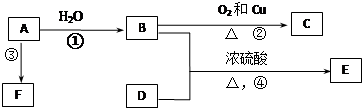 下列各有机物转化关系如图,A具有催热水果的作用;D能使石蕊试液变红;E是不溶于水的E是不溶于水且具有香味的无色液体,相对分子质量是C的2倍;F是高分子化合物,常用于制食品包装袋.结合如图关系回答问题:
下列各有机物转化关系如图,A具有催热水果的作用;D能使石蕊试液变红;E是不溶于水的E是不溶于水且具有香味的无色液体,相对分子质量是C的2倍;F是高分子化合物,常用于制食品包装袋.结合如图关系回答问题: