题目内容
7.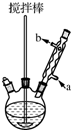 苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃).乙醚的沸点为34.6℃.实验室常用苯甲醛制备苯甲醇和苯甲酸.其原理为:
苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃).乙醚的沸点为34.6℃.实验室常用苯甲醛制备苯甲醇和苯甲酸.其原理为:2CHO+NaOH-→CH2OH+COONa
实验步骤如下:
①向图所示装置中加入适量NaOH、水和苯甲醛,混匀、加热,使反应充分进行.
②从冷凝管下口加入冷水,混匀,冷却.倒入分液漏斗,用乙醚萃取、分液.水层保留待用.将乙醚层依次用10% Na2CO3溶液、水洗涤.
③将乙醚层倒入盛有少量无水MgSO4的干燥锥形瓶中,混匀、静置后将其转入蒸馏装置,缓慢均匀加热除去乙醚,收集198℃~204℃馏分得苯甲醇.
④将步骤②中的水层和适量浓盐酸混合均匀,析出白色固体.冷却、抽滤得粗产品,将粗产品提纯得苯甲酸.
(1)步骤②中,最后用水洗涤的作用是除去NaOH、苯甲酸钠、碳酸钠等杂质.将分液漏斗中两层液体分离开的实验操作方法是:先把下层液体从下端放出后把上层液体从上口倒出.
(2)步骤③中无水MgSO4的作用是干燥剂.
(3)步骤④中水层和浓盐酸混合后发生反应的化学方程式为C6H5-COONa+HCl-→C6H5-COOH+NaCl;将反应后混合物冷却的目的是使苯甲酸尽可能多的析出.
(4)抽滤装置所包含的仪器除减压系统外,还有吸滤瓶、布氏漏斗(填仪器名称).
分析 (1)NaOH、苯甲酸钠、碳酸钠等易溶于水,苯甲酸在水中的溶解度不大;分液时,避免上下层液体混合,先分离出下层液体;
(2)无水MgSO4可吸收水;
(3)④中水层含苯甲酸钠,可与盐酸发生强酸制弱酸的反应;低温下苯甲酸的溶解度小;
(4)抽滤装置所包含的仪器除减压系统外,还需要布氏漏斗、吸滤瓶等.
解答 解:(1)NaOH、苯甲酸钠、碳酸钠等易溶于水,苯甲酸在水中的溶解度不大,则步骤②中,最后用水洗涤的作用是除去NaOH、苯甲酸钠、碳酸钠等杂质;分液时,避免上下层液体混合,操作为把下层液体从下端放出、把上层液体从上口倒出,
故答案为:除去NaOH、苯甲酸钠、碳酸钠等杂质;把下层液体从下端放出;把上层液体从上口倒出;
(2)无水MgSO4可吸收水,则步骤③中无水MgSO4的作用是干燥剂,故答案为:干燥剂;
(3)④中水层含苯甲酸钠,可与盐酸发生强酸制弱酸的反应,发生的反应为C6H5-COONa+HCl-→C6H5-COOH+NaCl;低温下苯甲酸的溶解度小,则将反应后混合物冷却的目的是使苯甲酸尽可能多的析出,
故答案为:C6H5-COONa+HCl-→C6H5-COOH+NaCl;使苯甲酸尽可能多的析出;
(4)抽滤装置所包含的仪器除减压系统外,还需要布氏漏斗、吸滤瓶等,故答案为:吸滤瓶;布氏漏斗.
点评 本题考查物质的制备实验,为高频考点,把握制备原理、实验技能为解答的关键,侧重分析与实验能力的考查,注意有机物的结构与性质及应用,题目难度不大.

练习册系列答案
相关题目
17.2.3g钠在干燥的空气中与O2反应,可得3.5g氧化物,据此可判断其产物为( )
| A. | 只有Na2O | B. | 只有Na2O2 | C. | Na2O和Na2O2 | D. | 无法确定 |
15.如表列出了A~R九种元素在周期表的位置:
(1)写出R单质分子的电子式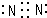 .
.
(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+.(用元素的离子符号表示).
(4)写出A的单质与水反应的离子方程式2Na+2H2O=2Na++OH-+H2↑.
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g,X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应,X的元素符号是Al,它位于元素周期表中位置第3周期第ⅢA族:
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
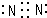 .
.(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+.(用元素的离子符号表示).
(4)写出A的单质与水反应的离子方程式2Na+2H2O=2Na++OH-+H2↑.
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g,X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应,X的元素符号是Al,它位于元素周期表中位置第3周期第ⅢA族:
2. 氨水是一种的常用的化学试剂.
氨水是一种的常用的化学试剂.
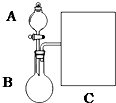
(1)以浓氨水和生石灰为原料,用如下装置为发生装置,可制取少量氨气.
已知:NH3•H2O+CaO=Ca(OH)2+NH3↑.
①生石灰应该装在B(填A或B).
②试从电离平衡角度分析该实验中氨气逸出的原因:CaO与水反应生成Ca(OH)2,溶液中OH-浓度增大,使NH3+H2O?NH4++OH-平衡逆向移动,有利于NH3逸出.
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置.
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显.影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二:反应(水浴)的温度.
②你设计实验验证上述影响因素一,完成下表中内容.
提供试剂:乙醛、2%稀氨水、0.25mol/L NaOH溶液、盐酸、2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
(3)吸取20.00ml 上述氨水于锥形瓶,滴加3滴甲基橙指示剂,用0.0050mol/L标准硫酸滴定,滴定至出现红色为终点,重复3次实验,平均消耗标准硫酸20.04ml,计算上述氨水的物质的量浓度0.01002 mol/L.
 氨水是一种的常用的化学试剂.
氨水是一种的常用的化学试剂.(1)以浓氨水和生石灰为原料,用如下装置为发生装置,可制取少量氨气.
已知:NH3•H2O+CaO=Ca(OH)2+NH3↑.
①生石灰应该装在B(填A或B).
②试从电离平衡角度分析该实验中氨气逸出的原因:CaO与水反应生成Ca(OH)2,溶液中OH-浓度增大,使NH3+H2O?NH4++OH-平衡逆向移动,有利于NH3逸出.
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置.
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显.影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二:反应(水浴)的温度.
②你设计实验验证上述影响因素一,完成下表中内容.
提供试剂:乙醛、2%稀氨水、0.25mol/L NaOH溶液、盐酸、2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
| 实验步骤 | 实验操作 | 预期现象及结论(步骤1只填现象) |
| 1 | 在A、B两支洁净的试管中各入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至最初产生的沉淀恰好完全溶解,此时制得pH均约为8的银氨溶液. | 先出现白色沉淀后沉淀溶解 |
| 2 | 往A、B试管加入3滴乙醛,然后在A试管中加多1滴NaOH溶液;振荡后将两支试管放在热水浴中温热 | 若A试管比B试管出现的银镜时间短、光亮,则溶液pH大,反应速率快;若A试管比B试管出现的银镜时间长,则溶液pH大,反应速率慢 |
12.下列化学用语正确的是( )
| A. | 8个中子的碳原子的核素符号:12C | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 氢氧根离子的电子式: | D. | Cl-离子结构示意图: |
19.利用如图装置探究铁在海水中的电化学防护,下列说法错误的是( )


| A. | 若X为锌棒,开关K置于M处,可减缓铁的腐蚀 | |
| B. | 若X为锌棒,开关K置于M处,铁电极的反应:Fe-2e→Fe2+ | |
| C. | 若X为碳棒,开关K置于N处,可减缓铁的腐蚀 | |
| D. | 若X为碳棒,开关K置于N处,铁电极的反应:2H++2e→H2↑ |
16.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如图1:

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
17.下列变化不属于氧化还原反应的是( )
| A. | Na2O+H2O═2NaOH | B. | Zn+H2SO4(稀)═ZnSO4+H2↑ | ||
| C. | 2AgNO3═2Ag+2NO2↑+O2↑ | D. | 3NO2+H2O═2HNO3+NO |
