题目内容
20. 用于合成氨的工业煤气中含有H2S、C2H5SH(乙硫醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理.
用于合成氨的工业煤气中含有H2S、C2H5SH(乙硫醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理.H2S+ZnO═ZnS+H2O;
C2H5SH+ZnO═ZnS+C2H4+H2O;
C2H5SH+H2═C2H6+H2S;
COS+H2═CO+H2S;
CS2+4H2═CH4+2H2S
(1)钴原子在基态时核外电子排布式为[Ar]3d74s2或1s22s22p63s23p63d74s2.
(2)下列有关分子结构的说法正确的是ABCD(填字母).
A.C2H4分子中有5个σ键和1个π键
B.COS分子(结构如图1)中键能C=O>C=S
C.H2S分子呈V形结构
D.CH4、C2H6分子中碳原子均采用sp3杂化
(3)下列有关说法不正确的是C (填字母).
A.H2O、CO、COS均是极性分子
B.相同压强下沸点:CS2>CO2
C.相同压强下沸点:C2H5SH>C2H5OH
D.相同压强下沸点:CO>N2
(4)β-ZnS的晶胞结构如图2,晶胞中S2数目为4 个.
(5)具有相似晶胞结构的ZnS和ZnO,ZnS熔点为1830℃,ZnO熔点为1975℃,后者较前者高是由于氧离子半径比硫离子小,晶格能大.
(6)钼的一种配合物化学式为:Na3[Mo(CN)8]•8H2O,中心原子的配位数为8.
分析 (1)钴元素的原子序数是27号,其原子核外有27个电子,根据构造原理书写其基态原子核外电子排布式;
(2)A.共价单键为σ键,共价双键中一个是σ键、一个是π键;
B.键长与键能成反比;
C.根据价层电子对互斥理论确定分子的空间构型;
D.根据据此电子对互斥理论确定原子的杂化方式;
(3)A.正负电荷重心不重合的为极性分子;
B.共价化合物的沸点与其相对分子质量成正比;
C.结构相似的分子,其沸点与相对分子质量成正比,氢键能增大物质的沸点;
D.相对分子质量相同的分子,其沸点还与分子的极性有关;
(4)利用均摊法计算硫离子的数目;
(5)具有相似晶胞结构的ZnS和ZnO,ZnS熔点为1830℃,ZnO熔点为1975℃,熔点大小与离子晶体的晶格能成正比,晶格能与离子半径成反比;
(6)Mo原子的配位数是8.
解答 解:(1)钴元素的原子序数是27号,其原子核外有27个电子,根据构造原理知,其基态原子核外电子排布式[Ar]3d74s2或1s22s22p63s23p63d74s2,
故答案为:[Ar]3d74s2或1s22s22p63s23p63d74s2;
(2)A.共价单键为σ键,共价双键中一个是σ键、一个是π键,C2H4分子中有5个σ键和1个π键,故A正确;
B.键长与键能成反比,C=O的键长小于C=S,所以COS分子(结构如图1)中键能C=O>C=S,故B正确;
C.硫化氢分子中,硫原子中含有2个共用电子对和2个孤电子对,则H2S分子呈V形结构,故C正确;
D.甲烷分子和乙烷分子中,每个碳原子都含有4个共价单键,所以CH4、C2H6分子中碳原子均采用sp3杂化,故D正确;
故选ABCD;
(3)A.H2O、CO、COS分子中正负电荷重心不重合,所以均是极性分子,故A正确;
B.CS2、COS、CO2的结构相似,其沸点与相对分子质量成正比,所以同压强下沸点:CS2>CO2,故B正确;
C.结构相似的分子,其沸点与相对分子质量成正比,氢键能增大物质的沸点,所以相同压强下沸点:C2H5SH<C2H5OH,故C错误;
D.CO沸点比N2高和分子的极性有关,前者是极性分子,后者是非极性分子,所以 相同压强下沸点:CO>N2,故D正确;
故选C;
(4)根据图知,硫离子个数=$8×\frac{1}{8}+6×\frac{1}{2}$=4,
故答案为:4;
(5)离子晶体的熔点与晶格能成正比,晶格能与离子半径成反比,氧化锌和硫化锌中,氧离子半径小于硫离子,所以氧化锌的晶格能大于硫化锌,则氧化性的熔点高于硫化锌,
故答案为:氧离子半径比硫离子小,晶格能大;
(6)Na3[Mo(CN)8]•8H2O中中心原子的配位数是8,故答案为:8.
点评 本题考查物质结构和性质,涉及知识点较多,同时考查学生空间想象能力、知识运用能力,难度较大.

| A. | 0.1molNa2O2中含有的离子数为0.4NA | |
| B. | 利用氧化还原反应原理制取1mol氧气,转移的电子数一定为4NA | |
| C. | 7.1g氯气与足量NaOH溶液反应电子转移数为0.2NA | |
| D. | 0.1mol氯气与金属铁完全反应时,转移电子数为0.2NA |
下表是一些键能数据(KJ•mol-1):
| 键能 | 键能 | 键能 | 键能 | ||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | H-O | 464 |
| S=S | 255 | H-S | 339 | C-F | 427 | C-O | 347 |
| C-Cl | 330 | C-I | 218 | H-F | 565 |
由表中数据能否得出这样的结论:
(1)半径越小的原子形成的共价键越牢固(即键能越大)不能(填“能”或“不能”)
(2)非金属性越强的原子形成的共价键越牢固不能(填“能”或“不能”).能否从数据找出一些规律,请写出一条:与相同原子结合时同主族元素形成的共价键,原子半径越小,共价键越强;
(3)试预测C-Br键的键能范围218KJ•mol-1<C-Br键能<330KJ•mol-1.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
 .
.(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH (填化学式).
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为K+>Na+>Mg2+.(用元素的离子符号表示).
(4)写出A的单质与水反应的离子方程式2Na+2H2O=2Na++OH-+H2↑.
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g,X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应,X的元素符号是Al,它位于元素周期表中位置第3周期第ⅢA族:
| A. | 8个中子的碳原子的核素符号:12C | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 氢氧根离子的电子式: | D. | Cl-离子结构示意图: |
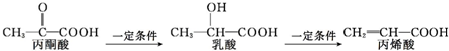
下列叙述错误的是( )
| A. | 三种有机物中都存在2种官能团 | |
| B. | 乳酸和丙烯酸都能使高锰酸钾酸性溶液褪色 | |
| C. | 1 mol乳酸最多能与2 mol Na发生反应 | |
| D. | 三种有机物均能发生聚合反应生成高分子化合物 |
| A. | 食醋 | B. | 白酒 | C. | 食盐 | D. | 葡萄糖 |