题目内容
18.把6moLM和5moLN的混合气体通入容积为4L的密闭容器中,在一定条件下发生如下反应:5M(g)+4N(g)?6P(g)+xQ(g),经5min后反应达到平衡,此时生成P 3moL,并测得Q的平均反应速率为0.1mol/(L•min)下列说法正确的是( )| A. | 化学计量数x=2 | B. | M的转化率为41.67% | ||
| C. | N的平衡浓度为0.075mol/L | D. | 反应前后混合气体的压强比为$\frac{23}{22}$ |
分析 经5min后反应达到平衡,此时生成P 3moL,则v(P)=$\frac{\frac{3mol}{4L}}{5min}$=0.15mol/(L•min),Q的平均反应速率为0.1mol/(L•min),由速率之比等于化学计量数之比可知,$\frac{0.15}{0.1}=\frac{6}{x}$,解得x=4,则
5M(g)+4N(g)?6P(g)+4Q(g)
开始 6 5 0 0
转化 2.5 2 3 2
平衡 3.5 3 3 2
结合c=$\frac{n}{V}$、转化率=$\frac{转化的量}{开始的量}$×100%、物质的量比等于压强比来解答.
解答 解:经5min后反应达到平衡,此时生成P 3moL,则v(P)=$\frac{\frac{3mol}{4L}}{5min}$=0.15mol/(L•min),Q的平均反应速率为0.1mol/(L•min),由速率之比等于化学计量数之比可知,$\frac{0.15}{0.1}=\frac{6}{x}$,解得x=4,则
5M(g)+4N(g)?6P(g)+4Q(g)
开始 6 5 0 0
转化 2.5 2 3 2
平衡 3.5 3 3 2
A.由上述分析可知,x=4,故A错误;
B.M的转化率为$\frac{2.5}{6}$×100%=41.67%,故B正确;
C.N的平衡浓度为$\frac{3mol}{4L}$=0.75mol/L,故C错误;
D.反应前后混合气体的压强比为(6+5):(3.5+3+3+2)=$\frac{22}{23}$,故D错误;
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率及速率的计算为解答的关键,侧重分析与计算能力的考查,注意x的确定方法,题目难度不大.

| A. | HCOOCH3和CH3CHO表示同一种物质 | |
| B. | C2H5OH在NaOH水溶液中加热,可发生消去反应生成乙烯 | |
| C. | 医用酒精的浓度通常为95% | |
| D. | 蛋白质遇到浓硝酸,得到黄色沉淀 |
| A. | $\frac{m}{32}$mol | B. | $\frac{m}{64}$mol | C. | $\frac{n}{11.2}$mol | D. | $\frac{n}{22.4}$mol |
| 阳离子 | Al3+、Ba2+ |
| 阴离子 | OHˉ、SO42ˉ、Clˉ |
| A. | 往甲和乙的混合溶液中加入过量的丁溶液一定会生成白色沉淀 | |
| B. | 丙和丁的水溶液混合后会生成白色沉淀 | |
| C. | 一定温度下,丙溶于水会使水的电离程度增大 | |
| D. | 一定温度下,甲溶于水会使水的电离程度减小 |
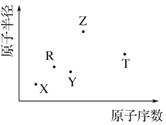 短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )
短周期主族元素 X、Y、Z、R、T 的原子半径与原子序数关系如图 所示.R 原子最外层电子数是电子层数的 2 倍,Y 与 Z 能形成 Z2Y、Z2Y2型离子化合物,Z 与 T 形成的化合物 Z2T 能破坏水的电离平衡.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 最高价氧化物对应水化物的酸性:T<R | |
| C. | 氢化物的沸点不一定是:Y>R | |
| D. | 由 X、R、Y、Z 四种元素组成的化合物水溶液一定显碱性 |
| A. | KClO3是氧化剂 | B. | P2O5是氧化产物 | ||
| C. | 1molKClO3参加反应有6mole-转移 | D. | 每有6molP被还原,生成5molKCl |
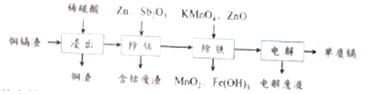
表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol•L-1计算):
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.2 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 | 10.6 |
(2)除钴的过程中,需要加入活化剂Sb2O3,锌粉会与Sb2O3等形成微电池产生合金CoSb.该微电池的正极反应式为Sb2O3+Co2++6H++10e-=2CoSb+3H2O
(3)除铁的过程分两步进行,①加入适量KMnO4,发生反应的离子方程式为3Fe2++MnO4-+4H+=3Fe3++MnO2+2H2O,②加入ZnO控制反应液的PH范围为3.3-7.2
(4)除铁过程第①步,若加入KMnO4时条件控制不当,MnO2会继续反应,造成的结果是,若加入的KMnO4不足量,则待电解溶液中有Fe元残余.请设计实验方案加以验证.
(5)净化后的溶液用惰性电极电解可获得镉单质.电解废液中可循环利用的溶质是H2SO4
(6)处理含镉废水常用化学沉淀法,以下是几种镉的难溶化合物的溶度积常数(25℃):
Kap(CdCO3)=5.2×10-12
Kap(CdS)=3.6×10-29
Kap(Cd(OH)2)=2.0×10-16,根据上述信息:
沉淀Cd2+效果最佳的试剂是b
a.Na2CO3 b.Na2S c.CaO
若采用生石灰处理含镉废水最佳PH为11,此时溶液中c(Cd2+)=2.0×10-10 mol•L-1.
 .
.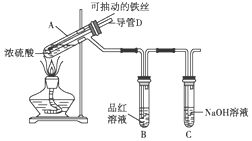 合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.
合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.