题目内容
13.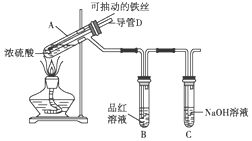 合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.
合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.(1)已知C中盛有足量的氢氧化钠溶液,实验过程中,观察到B中的品红溶液褪色,C中发生反应的离子方程式为SO2+2OH-═SO32-+H2O. 一段时间后,观察到C中有少量气泡冒出,此气泡的成分是H2.
(2)用“可抽动的铁丝”代替“直接投入铁片”的优点是便于控制铁与浓硫酸的反应和停止;
(3)实验完毕后,先熄灭酒精灯,由于导管D的存在,B中的液体不会倒吸入A中,其原因是当A中气体压强减小时,外界大气压不变,空气从D进入A,使A中压强平衡.
(4)反应结束后,不需要打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是从D管口向A中鼓入大量的空气,将残留的二氧化硫赶入NaOH溶液中,使其完全被吸收.
(5)设计实验检验反应后试管A中所得溶液里是否含有亚铁离子,可选用的试剂为BD
A.NaOH溶液 B.铁氰化钾溶液 C.KSCN溶液和双氧水 D.酸性高锰酸钾溶液.
分析 浓硫酸和Fe在加热条件下发生氧化还原反应生成硫酸Fe、二氧化硫和水,Fe能和硫酸铁反应生成硫酸亚铁,当浓硫酸达到一定浓度后变为稀硫酸,Fe和稀硫酸反应生成硫酸亚铁和氢气,二氧化硫能使品红溶液褪色,所以看到B中溶液褪色,二氧化硫为酸性氧化物,能被碱性溶液吸收,所以C的作用是吸收二氧化硫,以此解答该题.
解答 解:(1)二氧化硫有毒,需要用氢氧化钠溶液吸收,二者反应生成亚硫酸钠和水,反应的离子方程式为:SO2+2OH-═SO32-+H2O;
A中开始可能发生的反应有:2Fe+6H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O、Fe+Fe2(SO4)3=3FeSO4,随着反应的进行,浓硫酸变为稀硫酸,铁与稀硫酸反应产生氢气,氢气不和NaOH反应,所以C中逸出的气体是H2;
故答案为:SO2+2OH-═SO32-+H2O;H2;
(2)将抽动的铁丝脱离液面,反应停止,将抽动的铁丝插入液面,反应开始,
故答案为:便于控制铁与浓硫酸的反应和停止;
(3)当A中气体压强减小时,外界大气压不变,空气从E进入A,使A中压强平衡,所以B中压强不会产生倒吸,
故答案为:当A中气体压强减小时,外界大气压不变,空气从D进入A,使A中压强平衡;
(4)SO2有毒不能直接排空,为防止SO2污染空气,应该将装置中气体全部通入NaOH溶液中,使SO2被完全吸收,其基本操作方法为从D管口向A中鼓入大量的空气,将残留的二氧化硫赶入NaOH溶液中,使其完全被吸收,
故答案为:从D管口向A中鼓入大量的空气,将残留的二氧化硫赶入NaOH溶液中,使其完全被吸收;
(5)亚铁离子能和铁氰化钾反应生成特征蓝色沉淀,也能将酸性高锰酸钾溶液还原而使酸性高锰酸钾溶液褪色,铁离子和铁氰化钾及酸性高锰酸钾溶液都不反应,所以可以选取铁氰化钾或酸性高锰酸钾溶液检验亚铁离子,
故答案为:BD.
点评 本题以浓硫酸和Cu反应为载体考查性质实验方案设计,题目难度中等,明确实验原理是解本题关键,侧重考查学生实验操作、分析能力,知道各个装置目的、作用、发生的反应及实验现象,试题培养了学生的分析能力及化学实验能力.

| A. | 元素周期表有7个周期和18个族 | |
| B. | 由短周期元素和长周期元素共同组成的族一定是主族 | |
| C. | 从左向右数第13列是第ⅢB族 | |
| D. | 元素周期表中0族元素的单质全部是气体 |
| A. | 溴化银是一种重要的感光材料,是胶卷中的核心成分之一 | |
| B. | 硅晶体是一种重要的半导体材料,还可用于制造光导纤维 | |
| C. | 镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 | |
| D. | 硫酸钡不容易被X射线透过,在医疗上可用作检查肠胃的内服药剂 |
| A. | 向稀盐酸中加入少量金属钠:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 向氯化铁溶液中滴加碳酸氢钠溶液:2Fe3++3CO32-+3H2O═2Fe(OH)3↓+3CO2↑ | |
| C. | NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+H2O | |
| D. | 将过量的SO2通入漂白粉溶液中:Ca2++2ClO-+2SO2+2H2O═CaSO4↓+2Cl-+4H++SO42- |
| A. | 化学计量数x=2 | B. | M的转化率为41.67% | ||
| C. | N的平衡浓度为0.075mol/L | D. | 反应前后混合气体的压强比为$\frac{23}{22}$ |
| A. | 泥水 | B. | 蒸馏水 | C. | 硫酸铜溶液 | D. | 氢氧化铁胶体 |
| A. | 只有Cu2+ | B. | Fe2+、Cu2+ | C. | Fe3+、Fe2+ | D. | Fe3+、Cu2+ |
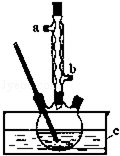 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为: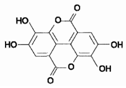 紫薯中的鞣花酸(结构如图)具有防癌和抗癌作用.
紫薯中的鞣花酸(结构如图)具有防癌和抗癌作用.