题目内容
8.利用湿法炼锌产生的铜镉渣生产金属镉的流程如图:已知铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质.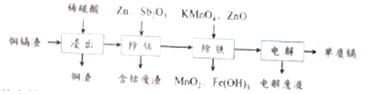
表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol•L-1计算):
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.2 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 | 10.6 |
(2)除钴的过程中,需要加入活化剂Sb2O3,锌粉会与Sb2O3等形成微电池产生合金CoSb.该微电池的正极反应式为Sb2O3+Co2++6H++10e-=2CoSb+3H2O
(3)除铁的过程分两步进行,①加入适量KMnO4,发生反应的离子方程式为3Fe2++MnO4-+4H+=3Fe3++MnO2+2H2O,②加入ZnO控制反应液的PH范围为3.3-7.2
(4)除铁过程第①步,若加入KMnO4时条件控制不当,MnO2会继续反应,造成的结果是,若加入的KMnO4不足量,则待电解溶液中有Fe元残余.请设计实验方案加以验证.
(5)净化后的溶液用惰性电极电解可获得镉单质.电解废液中可循环利用的溶质是H2SO4
(6)处理含镉废水常用化学沉淀法,以下是几种镉的难溶化合物的溶度积常数(25℃):
Kap(CdCO3)=5.2×10-12
Kap(CdS)=3.6×10-29
Kap(Cd(OH)2)=2.0×10-16,根据上述信息:
沉淀Cd2+效果最佳的试剂是b
a.Na2CO3 b.Na2S c.CaO
若采用生石灰处理含镉废水最佳PH为11,此时溶液中c(Cd2+)=2.0×10-10 mol•L-1.
分析 用湿法炼锌产生的铜镉渣生产金属镉的流程:铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质,加入稀硫酸,铜不溶,过滤,滤液含有Zn2+、Fe2+、Cd2+、Zn2+、Co2+,向滤液加入锌,活化剂Sb2O3,锌粉会与Sb2O3等形成微电池产生合金CoSb除去钴,向除钴后的溶液中加入酸性高锰酸钾氧化Fe2+为Fe3+,高锰酸钾生成不溶的二氧化锰,加入氧化锌调节pH使Fe3+沉淀与二氧化锰一起过滤除去,电解含有Zn2+、Co2+的溶液,可得镉单质,据此分析解答.
解答 解:(1)适当升高温度、搅拌、增大硫酸的浓度、经铜镉渣研成粉末可提高铜镉渣浸出的速率,浸出钴的化学方程式为Co+H2SO4=CoSO4+H2↑;
故答案为:增大硫酸的浓度(经铜镉渣研成粉末);Co+H2SO4=CoSO4+H2↑;
(2)锌粉会与Sb2O3等形成微电池产生合金CoSb,正极得电子发生还原反应,反应式为:Sb2O3+Co2++6H++10e-=2CoSb+3H2O;
故答案为:Sb2O3+Co2++6H++10e-=2CoSb+3H2O;
(3)除铁的过程分两步进行,①加入适量KMnO4,酸性高锰酸钾氧化Fe2+为Fe3+,高锰酸钾生成不溶的二氧化锰,发生反应的离子方程式为3Fe2++MnO4-+4H+=3Fe3++MnO2+2H2O;加入ZnO控制反应液的PH,目的是沉淀铁离子,由表可知,pH大于3.3时,铁离子沉淀完全,但不能沉淀Cd2+,pH小于7.2,则范围为3.3-7.2;
故答案为:3Fe2++MnO4-+4H+=3Fe3++MnO2+2H2O;3.3-7.2;
(4)除铁过程第①步,若加入KMnO4时条件控制不当,MnO2会继续反应生成Mn2+,还原产物Mn2+,进入电解液中,引入杂质;
若加入的KMnO4不足量,则待电解溶液中有亚铁离子残余,检验亚铁离子即可,方法为:取样,向其中滴加H2O2后再滴入KSCN溶液,若溶液变红(或向其中滴加K3[Fe(CN)6)]溶液,若产生蓝色沉淀),则待电解液中含有Fe元素;
故答案为:还原产物Mn2+,进入电解液中,引入杂质;取样,向其中滴加H2O2后再滴入KSCN溶液,若溶液变红(或向其中滴加K3[Fe(CN)6)]溶液,若产生蓝色沉淀),则待电解液中含有Fe元素;
(5)电解液中含有含有ZnSO4、CoSO4的溶液,电解发生的反应为:2CoSO4+2H2O=2Cd+O2↑+2H2SO4,硫酸可循环利用;
故答案为:H2SO4;
(6)根据溶度积常数大小分析,Ksp越小,溶解度越小,沉淀越完全,由表格可知CdS的Ksp最小,所以应选Na2S作沉淀剂;处理含镉废水最佳PH为11,根据Ksp=c(Cd2+)•c2(OH-)=2.0×10-16,已知c(OH-)=10-3,则c(Cd2+)=2.0×10-10 mol•L-1;
故答案为:b;2.0×10-10 mol•L-1.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、溶度积的计算等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.

| A. | 化学计量数x=2 | B. | M的转化率为41.67% | ||
| C. | N的平衡浓度为0.075mol/L | D. | 反应前后混合气体的压强比为$\frac{23}{22}$ |
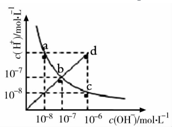
| A. | ac曲线上的任意一点都有c(H+)×c(OH-)=10-14 | |
| B. | CH3COONa溶液不可能位于c点 | |
| C. | d点对应溶液的温度高于25°C,PH<7 | |
| D. | bd线段上任意一点对应的溶液都呈中性 |
| A. | nCH2=CH2$\stackrel{催化剂}{→}$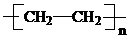 | |
| B. | CH2=CH2+Br2→CH3CHBr2 | |
| C. | 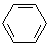 +HNO3$→_{60℃}^{浓硫酸}$ +HNO3$→_{60℃}^{浓硫酸}$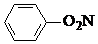 +H2O +H2O | |
| D. | CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH3CH2+H2O |
| A. | Q、R的最高价氧化物对应水化物间可反应 | |
| B. | Y的简单氢化物比Z的简单氢化物稳定 | |
| C. | 可通过电解熔融氯化物的方法制备Q、R | |
| D. | X元素单质在化学反应中只表现还原性 |
| 编号 | 实验内容 | 实验目的 |
| A | 室温下,用pH试纸测得:0.1mol•L-1Na2SO3溶液的pH约为10;0.1mol•L-1NaHSO3溶液的pH约为5 | HSO3-结合H+的能力比SO32-强 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 配置FeCl2溶液时,先将FeCl2固体溶于适量盐酸中,再用蒸馏水稀释到所需浓度,最后向试剂瓶中加入少量铜粉 | 抑制Fe2+2水解,并防止Fe2+被氧化 |
| D | 向10mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,在滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| A. | A | B. | B | C. | C | D. | D |
| A. | 2-甲基丁烷也称异丁烷 | |
| B. | 乙烯、苯都能发生加成反应 | |
| C. | 乙烯、聚氯乙烯分子中都含有碳碳双键 | |
| D. | 淀粉、油脂、蛋白质都属于高分子化合物 |
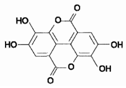 紫薯中的鞣花酸(结构如图)具有防癌和抗癌作用.
紫薯中的鞣花酸(结构如图)具有防癌和抗癌作用.