题目内容
18.某同学看到“利用零价铁还原脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与溶液的反应.实验过程如下:i.打开弹簧夹,缓慢通入,并保持后续反应均在氛围中进行;
ii.加入pH 已调至2.5 的 0.01mol•酸性溶液100mL,一段时间后铁粉部分溶解,
溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现,剩余固体表面有少量白色物质附着;
iii.过滤剩余固体时,表面的白色物质变为红褐色;
iv.检测到滤液中存在.
(1)通入并保持后续反应均在2N 氛围中进行的实验目的是避免空气中的氧气对铁和硝酸根离子的反应产生干扰.
(2)白色物质是Fe(OH)2,用化学方程式解释其变为红褐色的原因:4Fe(OH)2+O2+H2O=4Fe(OH)3.
(3)用检验滤液中 的实验方案是取滤液,向其中滴加几滴K3[Fe(CN)6].若观察到蓝色沉淀,则证明滤液中存在二价铁离子.
(4)取少量滤液,向其中加入几滴KSCN 溶液,无明显现象;再加入几滴稀硫酸,溶液呈红色.溶液变成红色的原因是溶液中存在Fe2+、NO3-离子,加入硫酸,发生反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,生成的Fe3+和SCN-反应使溶液呈红色.
(5)该同学进一步查阅资料发现,用铁粉、碳粉的混合物脱除硝酸盐,效果更佳.他用上述溶液继续设计如下实验,探究碳粉的作用.
| 假设 | 实验操作 | 现象及结论 |
| 假设1:碳粉可用作还原剂,脱除硝酸盐 | 向烧杯中加入① 碳粉,一段时间后,测定烧杯中NO3-的浓度 | NO3-浓度无明显变化,说明假设Ⅰ不成立 |
| 假设2:碳粉、铁粉形成无数个微小的原电池,促进了硝酸盐的脱除 | 按图示组装实验装置,一段时间后,测定NO3-浓度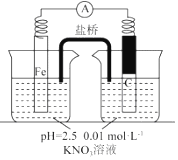 | ② Fe电极部分溶解,电流计指针偏转,说明假设2成立 |
分析 (1)空气中氧气会影响Fe与硝酸根离子的反应;
(2)铁粉部分溶解,溶液逐渐变为浅绿色,说明有Fe2+生成,酸性减弱Fe2+水解得到Fe(OH)2,氢氧化亚铁被氧化为氢氧化铁,颜色变为红褐色;
(3)取滤液,加入几滴K3[Fe(CN)6]溶液,有蓝色沉淀生成,注明滤液中存Fe2+;
(4)溶液中存在亚铁离子、硝酸根离子,亚铁离子含有还原性,硝酸根再酸性条件下具有氧化性,亚铁离子被氧化为铁离子;
(5)假设1:探究的是碳粉直接与NO3-反应效果,加入碳粉即可,作对照试验,溶液选取与原题中相同;
假设2:构成原电池,负极电极反应式:Fe-2e-=Fe2+,正极NO3-被还原;
③碳粉作为催化剂,提高脱除硝酸盐反应速率.
解答 解:(1)用氮气排尽装置中空气,避免空气中氧气对Fe与NO3-离子反应的干扰,
故答案为:避免空气中氧气对Fe与NO3-离子反应的干扰;
(2)铁粉部分溶解,溶液逐渐变为浅绿色,说明有Fe2+生成,待铁粉不再溶解,静置后发现,剩余固体表面有少量白色物,酸性减弱Fe2+水解得到Fe(OH)2,白色物质为氢氧化亚铁,被氧化为氢氧化铁,颜色变为红褐色,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:Fe(OH)2;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)用K3[Fe(CN)6]检验滤液中Fe2+的实验方案是:取滤液,加入几滴K3[Fe(CN)6]溶液,有蓝色沉淀生成,证明滤液中存Fe2+,
故答案为:取滤液,加入几滴K3[Fe(CN)6]溶液,有蓝色沉淀生成,证明滤液中存Fe2+;
(4)溶液中存在Fe2+、NO3-离子,加入硫酸,发生反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,生成的Fe3+和SCN-反应使溶液呈红色,
故答案为:溶液中存在Fe2+、NO3-离子,加入硫酸,发生反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,生成的Fe3+和SCN-反应使溶液呈红色;
(5)假设1:探究的是碳粉直接与NO3-反应效果,加入碳粉即可,作对照试验,溶液选取与原题中相同;
假设2:构成原电池,负极电极反应式:Fe-2e-=Fe2+,正极NO3-被还原,Fe电极部分溶解,电流计指针偏转等,说明假设2成立,
③碳粉作为催化剂,提高脱除硝酸盐反应速率,
故答案为:碳粉;Fe电极部分溶解,电流计指针偏转;碳粉作为催化剂,提高脱除硝酸盐反应速率.
点评 本题考查探究实验方案问题,是对学生综合能力的考查,需要学生具备扎实的基础、分析解决问题的能力,注意对基础知识的理解掌握.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案| 实验 | 操作 | |
| A | 配制0.1mol•L-1氯化铝溶液 | 先将氯化铝晶体溶于浓盐酸中,后加蒸馏水稀释至指定体积 |
| B | 在加热条先下氢气还原氧化铜 | 反应完成后,先停止通入氢气,后停止加热 |
| C | 浓盐酸与碳酸钙反应制备CO2 | 气体产物先通过浓硫酸,后通过饱和碳酸氢钠溶液 |
| D | 检验某溶液是否含SO42- | 先加入BaCl2溶液,后加入盐酸 |
| A. | A | B. | B | C. | C | D. | D |
(1)石墨和金刚石哪种单质更稳定石墨;
(2)试推测石墨与金刚石各1mol在相同条件下燃烧,金刚石放出的热量多.
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液,生成白色沉淀 | 该溶液中不一定含有SO42- |
| B | 光洁的铁钉放在冷的浓硫酸中,无明显现象 | 铁钉与冷的浓硫酸不反应 |
| C | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡静置,下层分别呈无色和紫红色 | 氧化性:Br2>Fe3+>I2 |
| D | 向浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1的AgNO3溶液,产生的沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(2)己知:常温下,0.1mol/L的某酸H2A的pH=4,则该酸为弱酸(填“强”或“弱”).
H2A的电离方程式为H2A
 H++HA-,该滚液中由水电离出的c(H+)=10-10mol/L.
H++HA-,该滚液中由水电离出的c(H+)=10-10mol/L.(3)25℃时,0.1mol/L的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}=1{0}^{10}$.0.010.1mol/L的BOH溶液pH=12,请回答下列问题:
①HA是弱电解质(填”强电解质”或“弱电解质”,下同).
②在加水稀释HA的过程中,随着水量的增加而减小的是B(填字母).
A.$\frac{c({H}^{+})}{c(HA)}$ B.$\frac{c(HA)}{c({A}^{-})}$ C.(H+)与c(OH-)的乘积 D.c(OH-)
③在体积相等、pH相等的HA溶液与盐酸溶液中加入足量Zn,HA溶液中产生的气体比盐酸中产生的气体多(填“多”“少”或“相等”).
| A. | 次氯酸的电子式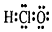 | B. | 二氧化硅的分子式:SiO2 | ||
| C. | 中子数为18的铝原子:1735Cl | D. | 钠离子的结构示意图: |
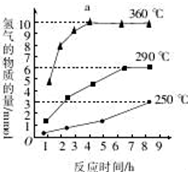 磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:
磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答: