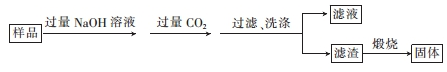题目内容
13.已知在高温、高压、催化剂作用下,石墨可转化为金刚石,并吸收1.9KJ/mol的热量.(1)石墨和金刚石哪种单质更稳定石墨;
(2)试推测石墨与金刚石各1mol在相同条件下燃烧,金刚石放出的热量多.
分析 (1)物质含有能量越低越稳定;
(2)焓变等于生成物能量与反应物能量差值.
解答 解:(1)根据题干信息知,石墨转化为金刚石需要吸收能量,则金刚石能量大于石墨,物质能量越低越稳定,所以石墨比金刚石稳定;
故答案为:石墨;
(2)△H=生成物能量-反应物能量,因为金刚石能量高,所以相同物质的量的金刚石和石墨在相同条件下燃烧,金刚石放出的热量多,
故答案为:金刚石.
点评 本题考查了金刚石和石墨相互转化中的能量变化,理解焓变的求算、物质的能量越低越稳定等知识是解题关键,题目难度不大.

练习册系列答案
相关题目
4.下列关于金属的一些说法不正确的是( )
| A. | 合金的性质与其成分金属的性质不完全相同 | |
| B. | 工业上金属Mg、Al都是用电解熔融的氯化物制得的 | |
| C. | 黑色的氧化铜灼烧会变成砖红色 | |
| D. | 将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 |
8.为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验.
实验I:反应产物的定性探究--按如图装置(固定装置已略)进行实验:
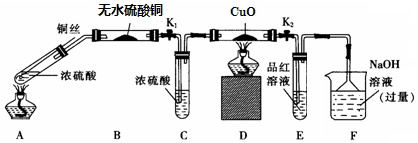
(1)F装置的烧杯中发生反应的离子方程式是SO2+2OH-=SO32-+H2O;
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是D装置中黑色固体颜色无变化,E装置中溶液褪色
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是拉起铜丝,关闭K1,K2
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是将A装置中试管内冷却后的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,若溶液变蓝,证明含有Cu2+;
,若溶液变蓝,证明含有Cu2+
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S.产生Cu2S的反应为
aCu+bH2SO4$\frac{\underline{\;\;△\;\;}}{\;}$cCu2S+dCuSO4+e H2O,则a:b=5:4
(6)为进一步探究该黑色物质的成分,经查阅相关文献获得下列资料.
资料1:
资料2:X-射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种.仅由上述资料可得出的如下结论中正确是ABD.
A.铜与浓硫酸反应时所涉及的反应可能不止一个
B.硫酸浓度选择适当,可避免最后产物中出现黑色物质
C.该反应发生的条件之一是硫酸浓度≥15mol/L
D.硫酸浓度越大,黑色物质越快出现、越难消失.
实验I:反应产物的定性探究--按如图装置(固定装置已略)进行实验:

(1)F装置的烧杯中发生反应的离子方程式是SO2+2OH-=SO32-+H2O;
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是D装置中黑色固体颜色无变化,E装置中溶液褪色
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是拉起铜丝,关闭K1,K2
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是将A装置中试管内冷却后的混合物沿杯壁(或玻璃棒)缓缓倒入盛有水的烧杯中,并不断搅拌,若溶液变蓝,证明含有Cu2+;
,若溶液变蓝,证明含有Cu2+
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S.产生Cu2S的反应为
aCu+bH2SO4$\frac{\underline{\;\;△\;\;}}{\;}$cCu2S+dCuSO4+e H2O,则a:b=5:4
(6)为进一步探究该黑色物质的成分,经查阅相关文献获得下列资料.
资料1:
| 硫酸/mol•L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 14 | Cu 片表面无明显现象 | |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
A.铜与浓硫酸反应时所涉及的反应可能不止一个
B.硫酸浓度选择适当,可避免最后产物中出现黑色物质
C.该反应发生的条件之一是硫酸浓度≥15mol/L
D.硫酸浓度越大,黑色物质越快出现、越难消失.
18.某同学看到“利用零价铁还原脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与溶液的反应.实验过程如下:
i.打开弹簧夹,缓慢通入,并保持后续反应均在氛围中进行;
ii.加入pH 已调至2.5 的 0.01mol•酸性溶液100mL,一段时间后铁粉部分溶解,
溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现,剩余固体表面有少量白色物质附着;
iii.过滤剩余固体时,表面的白色物质变为红褐色;
iv.检测到滤液中存在.
(1)通入并保持后续反应均在2N 氛围中进行的实验目的是避免空气中的氧气对铁和硝酸根离子的反应产生干扰.
(2)白色物质是Fe(OH)2,用化学方程式解释其变为红褐色的原因:4Fe(OH)2+O2+H2O=4Fe(OH)3.
(3)用检验滤液中 的实验方案是取滤液,向其中滴加几滴K3[Fe(CN)6].若观察到蓝色沉淀,则证明滤液中存在二价铁离子.
(4)取少量滤液,向其中加入几滴KSCN 溶液,无明显现象;再加入几滴稀硫酸,溶液呈红色.溶液变成红色的原因是溶液中存在Fe2+、NO3-离子,加入硫酸,发生反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,生成的Fe3+和SCN-反应使溶液呈红色.
(5)该同学进一步查阅资料发现,用铁粉、碳粉的混合物脱除硝酸盐,效果更佳.他用上述溶液继续设计如下实验,探究碳粉的作用.
③关于碳粉的作用,还可以提出的假设是碳粉作为催化剂,提高脱除硝酸盐反应速率.
i.打开弹簧夹,缓慢通入,并保持后续反应均在氛围中进行;
ii.加入pH 已调至2.5 的 0.01mol•酸性溶液100mL,一段时间后铁粉部分溶解,
溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现,剩余固体表面有少量白色物质附着;
iii.过滤剩余固体时,表面的白色物质变为红褐色;
iv.检测到滤液中存在.
(1)通入并保持后续反应均在2N 氛围中进行的实验目的是避免空气中的氧气对铁和硝酸根离子的反应产生干扰.
(2)白色物质是Fe(OH)2,用化学方程式解释其变为红褐色的原因:4Fe(OH)2+O2+H2O=4Fe(OH)3.
(3)用检验滤液中 的实验方案是取滤液,向其中滴加几滴K3[Fe(CN)6].若观察到蓝色沉淀,则证明滤液中存在二价铁离子.
(4)取少量滤液,向其中加入几滴KSCN 溶液,无明显现象;再加入几滴稀硫酸,溶液呈红色.溶液变成红色的原因是溶液中存在Fe2+、NO3-离子,加入硫酸,发生反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,生成的Fe3+和SCN-反应使溶液呈红色.
(5)该同学进一步查阅资料发现,用铁粉、碳粉的混合物脱除硝酸盐,效果更佳.他用上述溶液继续设计如下实验,探究碳粉的作用.
| 假设 | 实验操作 | 现象及结论 |
| 假设1:碳粉可用作还原剂,脱除硝酸盐 | 向烧杯中加入① 碳粉,一段时间后,测定烧杯中NO3-的浓度 | NO3-浓度无明显变化,说明假设Ⅰ不成立 |
| 假设2:碳粉、铁粉形成无数个微小的原电池,促进了硝酸盐的脱除 | 按图示组装实验装置,一段时间后,测定NO3-浓度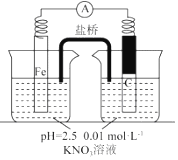 | ② Fe电极部分溶解,电流计指针偏转,说明假设2成立 |
2.下列实验操作能达到相应实验目的是
| 诜项 | 实验操作 | 实验目的 |
| A | 将乙烯通入酸性KMnO4溶液中 | 证明乙烯能发生加成反应 |
| B | 向含酚酞的NaOH溶液中加入氯水 | 证明Cl2具有漂白性 |
| C | 常温下,向Fe和Cu中分别加入浓硝酸 | 比较Fe和Cu的金属活动性 |
| D | 将铁钉放入试管中,下端浸入食盐水中 | 验证铁的吸氧腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
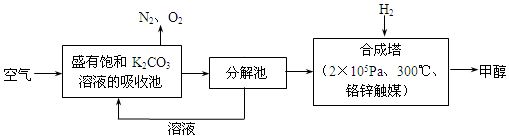

 .
.