题目内容
6.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)?NH3(g)+HI(g)
②2HI(g)?H2(g)+I2(g)
达到平衡时,c(H2)=1mol•L-1,c(HI)=5mol•L-1,则此温度下反应①的平衡常数为35.
分析 反应①的平衡常数k=c(NH3)•c(HI),NH4I分解生成的HI为平衡时HI与分解的HI之和,即为NH4I分解生成的NH3,由反应②可知分解的c(HI)为平衡时c(H2)的2倍,求出为NH4I分解生成的NH3,代入反应①的平衡常数K=c(NH3)•c(HI)计算.
解答 解:平衡时c(HI)=5mol•L-1,HI分解生成H2的浓度为1mol•L-1,
NH4I分解生成的HI的浓度为:5mol•L-1+2×1mol•L-1=7mol•L-1,所以NH4I分解生成NH3的浓度为7mol•L-1,
所以反应①的平衡常数为:K=c(NH3)•c(HI)=7×5=35,
故答案为:35.
点评 本题考查化学平衡的计算,题目难度不大,正确计算平衡时氨气的浓度为解答关键,注意掌握 化学平衡及其影响,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
13.甲烷分子中的四个氢原子都可以被取代.若甲烷分子中的四个氢被苯基取代,则可得到的分子为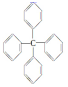 对该分子的描述,不正确的是( )
对该分子的描述,不正确的是( )
 对该分子的描述,不正确的是( )
对该分子的描述,不正确的是( )| A. | 化学式为C25H20 | B. | 所有碳原子都在同一平面上 | ||
| C. | 此分子中有极性键和非极性键 | D. | 此物质属芳香烃类物质 |
14.0.1molNa2SO4溶解在多少毫升水中,才能使每100个水分子中含有一个Na+离子( )
| A. | 200mL | B. | 20mL | C. | 360mL | D. | 36mL |
11.纳米材料粒子的直径为1-100nm.下列分散系中分散质的微粒直径和纳米材料属于相同数量的是( )
| A. | 溶液 | B. | 悬浊液 | C. | 胶体 | D. | 乳浊液 |
18.某同学看到“利用零价铁还原脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与溶液的反应.实验过程如下:
i.打开弹簧夹,缓慢通入,并保持后续反应均在氛围中进行;
ii.加入pH 已调至2.5 的 0.01mol•酸性溶液100mL,一段时间后铁粉部分溶解,
溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现,剩余固体表面有少量白色物质附着;
iii.过滤剩余固体时,表面的白色物质变为红褐色;
iv.检测到滤液中存在.
(1)通入并保持后续反应均在2N 氛围中进行的实验目的是避免空气中的氧气对铁和硝酸根离子的反应产生干扰.
(2)白色物质是Fe(OH)2,用化学方程式解释其变为红褐色的原因:4Fe(OH)2+O2+H2O=4Fe(OH)3.
(3)用检验滤液中 的实验方案是取滤液,向其中滴加几滴K3[Fe(CN)6].若观察到蓝色沉淀,则证明滤液中存在二价铁离子.
(4)取少量滤液,向其中加入几滴KSCN 溶液,无明显现象;再加入几滴稀硫酸,溶液呈红色.溶液变成红色的原因是溶液中存在Fe2+、NO3-离子,加入硫酸,发生反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,生成的Fe3+和SCN-反应使溶液呈红色.
(5)该同学进一步查阅资料发现,用铁粉、碳粉的混合物脱除硝酸盐,效果更佳.他用上述溶液继续设计如下实验,探究碳粉的作用.
③关于碳粉的作用,还可以提出的假设是碳粉作为催化剂,提高脱除硝酸盐反应速率.
i.打开弹簧夹,缓慢通入,并保持后续反应均在氛围中进行;
ii.加入pH 已调至2.5 的 0.01mol•酸性溶液100mL,一段时间后铁粉部分溶解,
溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现,剩余固体表面有少量白色物质附着;
iii.过滤剩余固体时,表面的白色物质变为红褐色;
iv.检测到滤液中存在.
(1)通入并保持后续反应均在2N 氛围中进行的实验目的是避免空气中的氧气对铁和硝酸根离子的反应产生干扰.
(2)白色物质是Fe(OH)2,用化学方程式解释其变为红褐色的原因:4Fe(OH)2+O2+H2O=4Fe(OH)3.
(3)用检验滤液中 的实验方案是取滤液,向其中滴加几滴K3[Fe(CN)6].若观察到蓝色沉淀,则证明滤液中存在二价铁离子.
(4)取少量滤液,向其中加入几滴KSCN 溶液,无明显现象;再加入几滴稀硫酸,溶液呈红色.溶液变成红色的原因是溶液中存在Fe2+、NO3-离子,加入硫酸,发生反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,生成的Fe3+和SCN-反应使溶液呈红色.
(5)该同学进一步查阅资料发现,用铁粉、碳粉的混合物脱除硝酸盐,效果更佳.他用上述溶液继续设计如下实验,探究碳粉的作用.
| 假设 | 实验操作 | 现象及结论 |
| 假设1:碳粉可用作还原剂,脱除硝酸盐 | 向烧杯中加入① 碳粉,一段时间后,测定烧杯中NO3-的浓度 | NO3-浓度无明显变化,说明假设Ⅰ不成立 |
| 假设2:碳粉、铁粉形成无数个微小的原电池,促进了硝酸盐的脱除 | 按图示组装实验装置,一段时间后,测定NO3-浓度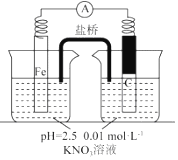 | ② Fe电极部分溶解,电流计指针偏转,说明假设2成立 |
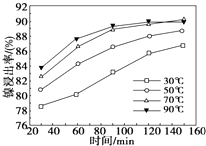 镍及其化合物具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.回答下列问题:
镍及其化合物具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.回答下列问题: .
.
 .
.