题目内容
9. 磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:
磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上是就会造成人畜中毒,请回答:(1)用碘化磷(PH4I)和烧碱反应制取PH3的化学方程式PH4I+NaOH═PH3↑+NaI+H2O.
(2)实验室用吸收硫酸铜溶液吸PH3时的化学方程式24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4 中氧化剂是CuSO4,当吸收2.2molPH3转移电子0.48mol
(3)氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐,生成物的物质的量之比为1:1:1,写出相应的化学方程式KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑.
(4)氧硫化碳水解及部分应用流程如下(部分产物已略去):
COS$→_{I}^{H_{2}O}$H2S$→_{Ⅱ}^{NaOH}$Na2S$→_{Ⅲ}^{△}$M溶液+H2
①组成氧硫化碳和磷化氢的各原子中,原子半径最大的元素在周期表中的位置是第三周期第VA族.
②已知M溶液中硫元素的主要存在形式为S2O32-,则反应Ⅲ中生成S2O32-的离子方程式为2S2-+5H${\;}_{{\;}_{2}}$O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-.
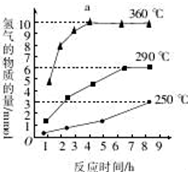
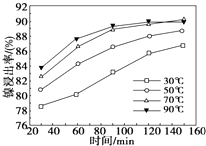
③如图是反应Ⅲ中,在不同反应温度下,反应时间与H2产量的关系(Na2S初始含量为3mmol).由图象分析可知,a点时M溶液中除S2O32-外,还有SO42-(填含硫微粒的离子符号).
分析 (1)用氯化磷(PH4I)和NaOH反应制取PH3的反应可以依据反应氯化铵和氢氧化钠反应生成氨气类推;
(2)据降得还原氧化剂,升失氧化还原剂来分析氧化剂和还原剂;据24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4~24mole-来计算转移电子数目;
(3)据题干分析并且确定化学方程式;
(4)①组成氧硫化碳和磷化氢的原子为O、S、P、H,先判断电子层数,电子层数越多,原子半径越大;电子层数相同,再根据元素周期律,同周期元素的原子半径随着原子序数的增大而减小,主族元素周期数=电子层数,主族序数=最外层电子数;
②依据题干信息:硫离子和水反应生成硫代硫酸根离子和氢气,依据电荷守恒和原子守恒书写离子反应方程式;
③根据图示反应时间与H2产量的关系,a点时M溶液中除S2O32-外,还有SO42-.
解答 解:(1)用氯化磷(PH4I)和NaOH反应为复分解反应生成PH3、碘化钠和水,制取PH3的化学方程式为:PH4 I+NaOH═PH3↑+NaI+H2O,
故答案为:PH4I+NaOH═PH3↑+NaI+H2O;
(2)24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4,CuSO4的化合价+2降低到+1价,化合价降低,故CuSO4为氧化剂,
24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4~24mole-
11 24
2.2 n
$\frac{11}{2.2}=\frac{24}{n}$,n=0.48
故答案为:CuSO4;0.48;
(3)氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐,生成物的物质的量之比为1:1:1,故方程式为:KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑,
故答案为:KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑
(4)①组成氧硫化碳和磷化氢的原子为O、S、P、H,氢元素有1个电子层,氧元素有2个电子层,磷、硫有3个电子层,所以磷、硫的原子半径大于氢、氧的原子半径,磷、硫是同周期元素,硫的原子序数大于磷的原子序数,由元素周期律知,磷的原子半径大于硫的原子半径,磷最外层为5个电子,处于第三周期第VA族,
故答案为:第三周期第VA族;
②依据题干信息:硫离子和水反应生成硫代硫酸根离子和氢气,根据硫原子守恒,产物需有因离子,根据原子守恒,产物还有氢氧根离子,反应为:2S2-+5H${\;}_{{\;}_{2}}$O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-,故答案为:2S2-+5H${\;}_{{\;}_{2}}$O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-;
③反应Ⅲ中,a点360℃时,随着时间推移,氢气的量不变,Na2S初始含量为3mmol,若只发生:2S2-+5H${\;}_{{\;}_{2}}$O$\frac{\underline{\;\;△\;\;}}{\;}$S2O32-+4H2↑+2OH-,生成氢气:3mmol×$\frac{4}{2}$=6mmol,图中为9mmol,说明M溶液中除S2O32-外,还有SO42-,反应为:S2-+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$SO42-+4H2↑,
故答案为:SO42-.
点评 本题考查了物质性质、原子半径大小的比较、电子式和离子反应方程式的书写等,注意电子层结构相同的离子半径大小的比较方法.注意图象变化的同种分析,题目难度中等

 计算高手系列答案
计算高手系列答案| A. | CH3CH=CH2和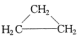 | B. | 乙炔和苯 | C. |  和 和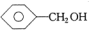 | D. | 乙酸和甲酸甲酯 |
| A. | 合金的性质与其成分金属的性质不完全相同 | |
| B. | 工业上金属Mg、Al都是用电解熔融的氯化物制得的 | |
| C. | 黑色的氧化铜灼烧会变成砖红色 | |
| D. | 将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 |
| A. | 200mL | B. | 20mL | C. | 360mL | D. | 36mL |
i.打开弹簧夹,缓慢通入,并保持后续反应均在氛围中进行;
ii.加入pH 已调至2.5 的 0.01mol•酸性溶液100mL,一段时间后铁粉部分溶解,
溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现,剩余固体表面有少量白色物质附着;
iii.过滤剩余固体时,表面的白色物质变为红褐色;
iv.检测到滤液中存在.
(1)通入并保持后续反应均在2N 氛围中进行的实验目的是避免空气中的氧气对铁和硝酸根离子的反应产生干扰.
(2)白色物质是Fe(OH)2,用化学方程式解释其变为红褐色的原因:4Fe(OH)2+O2+H2O=4Fe(OH)3.
(3)用检验滤液中 的实验方案是取滤液,向其中滴加几滴K3[Fe(CN)6].若观察到蓝色沉淀,则证明滤液中存在二价铁离子.
(4)取少量滤液,向其中加入几滴KSCN 溶液,无明显现象;再加入几滴稀硫酸,溶液呈红色.溶液变成红色的原因是溶液中存在Fe2+、NO3-离子,加入硫酸,发生反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,生成的Fe3+和SCN-反应使溶液呈红色.
(5)该同学进一步查阅资料发现,用铁粉、碳粉的混合物脱除硝酸盐,效果更佳.他用上述溶液继续设计如下实验,探究碳粉的作用.
| 假设 | 实验操作 | 现象及结论 |
| 假设1:碳粉可用作还原剂,脱除硝酸盐 | 向烧杯中加入① 碳粉,一段时间后,测定烧杯中NO3-的浓度 | NO3-浓度无明显变化,说明假设Ⅰ不成立 |
| 假设2:碳粉、铁粉形成无数个微小的原电池,促进了硝酸盐的脱除 | 按图示组装实验装置,一段时间后,测定NO3-浓度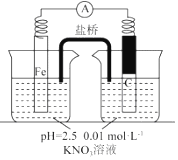 | ② Fe电极部分溶解,电流计指针偏转,说明假设2成立 |
 镍及其化合物具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.回答下列问题:
镍及其化合物具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.回答下列问题: .
.