题目内容
3.下列实验操作及现象与实验结论一致的是( )| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液,生成白色沉淀 | 该溶液中不一定含有SO42- |
| B | 光洁的铁钉放在冷的浓硫酸中,无明显现象 | 铁钉与冷的浓硫酸不反应 |
| C | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡静置,下层分别呈无色和紫红色 | 氧化性:Br2>Fe3+>I2 |
| D | 向浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1的AgNO3溶液,产生的沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.该沉淀可能为氯化银,原溶液中不一定含有硫酸根离子;
B.常温下铁与浓硫酸发生钝化现象;
C.能够证明溴单质的氧化性大于铁离子、碘单质,无法判断铁离子与碘单质的氧化性强弱;
D.难溶物越难溶,其溶度积越小.
解答 解:A.向某溶液中加入盐酸酸化的BaCl2溶液,生成白色沉淀,该沉淀可能为AgCl,原溶液中可能含有银离子,不一定含有SO42-,故A正确;
B.光洁的铁钉放在冷的浓硫酸中,常温下发生钝化,阻止了反应的继续进行,故B错误;
C.将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡静置,下层分别呈无色和紫红色,只能证明Br2的氧化性大于Fe3+、I2,无法比较Fe3+、I2的氧化性强弱,故C错误;
D.向浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1的AgNO3溶液,产生的沉淀呈黄色,说明AgI更难溶,则其溶度积较小,即Ksp(AgCl)>Ksp(AgI),故D错误;
故选A.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及离子检验、氧化还原反应、钝化、难溶物溶度积比较等知识,明确常见元素及其化合物性质即可解答,C为易错点,注意掌握比较氧化性强弱的方法,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
14.0.1molNa2SO4溶解在多少毫升水中,才能使每100个水分子中含有一个Na+离子( )
| A. | 200mL | B. | 20mL | C. | 360mL | D. | 36mL |
11.纳米材料粒子的直径为1-100nm.下列分散系中分散质的微粒直径和纳米材料属于相同数量的是( )
| A. | 溶液 | B. | 悬浊液 | C. | 胶体 | D. | 乳浊液 |
18.某同学看到“利用零价铁还原脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与溶液的反应.实验过程如下:
i.打开弹簧夹,缓慢通入,并保持后续反应均在氛围中进行;
ii.加入pH 已调至2.5 的 0.01mol•酸性溶液100mL,一段时间后铁粉部分溶解,
溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现,剩余固体表面有少量白色物质附着;
iii.过滤剩余固体时,表面的白色物质变为红褐色;
iv.检测到滤液中存在.
(1)通入并保持后续反应均在2N 氛围中进行的实验目的是避免空气中的氧气对铁和硝酸根离子的反应产生干扰.
(2)白色物质是Fe(OH)2,用化学方程式解释其变为红褐色的原因:4Fe(OH)2+O2+H2O=4Fe(OH)3.
(3)用检验滤液中 的实验方案是取滤液,向其中滴加几滴K3[Fe(CN)6].若观察到蓝色沉淀,则证明滤液中存在二价铁离子.
(4)取少量滤液,向其中加入几滴KSCN 溶液,无明显现象;再加入几滴稀硫酸,溶液呈红色.溶液变成红色的原因是溶液中存在Fe2+、NO3-离子,加入硫酸,发生反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,生成的Fe3+和SCN-反应使溶液呈红色.
(5)该同学进一步查阅资料发现,用铁粉、碳粉的混合物脱除硝酸盐,效果更佳.他用上述溶液继续设计如下实验,探究碳粉的作用.
③关于碳粉的作用,还可以提出的假设是碳粉作为催化剂,提高脱除硝酸盐反应速率.
i.打开弹簧夹,缓慢通入,并保持后续反应均在氛围中进行;
ii.加入pH 已调至2.5 的 0.01mol•酸性溶液100mL,一段时间后铁粉部分溶解,
溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现,剩余固体表面有少量白色物质附着;
iii.过滤剩余固体时,表面的白色物质变为红褐色;
iv.检测到滤液中存在.
(1)通入并保持后续反应均在2N 氛围中进行的实验目的是避免空气中的氧气对铁和硝酸根离子的反应产生干扰.
(2)白色物质是Fe(OH)2,用化学方程式解释其变为红褐色的原因:4Fe(OH)2+O2+H2O=4Fe(OH)3.
(3)用检验滤液中 的实验方案是取滤液,向其中滴加几滴K3[Fe(CN)6].若观察到蓝色沉淀,则证明滤液中存在二价铁离子.
(4)取少量滤液,向其中加入几滴KSCN 溶液,无明显现象;再加入几滴稀硫酸,溶液呈红色.溶液变成红色的原因是溶液中存在Fe2+、NO3-离子,加入硫酸,发生反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,生成的Fe3+和SCN-反应使溶液呈红色.
(5)该同学进一步查阅资料发现,用铁粉、碳粉的混合物脱除硝酸盐,效果更佳.他用上述溶液继续设计如下实验,探究碳粉的作用.
| 假设 | 实验操作 | 现象及结论 |
| 假设1:碳粉可用作还原剂,脱除硝酸盐 | 向烧杯中加入① 碳粉,一段时间后,测定烧杯中NO3-的浓度 | NO3-浓度无明显变化,说明假设Ⅰ不成立 |
| 假设2:碳粉、铁粉形成无数个微小的原电池,促进了硝酸盐的脱除 | 按图示组装实验装置,一段时间后,测定NO3-浓度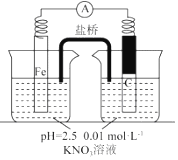 | ② Fe电极部分溶解,电流计指针偏转,说明假设2成立 |
8.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
①28g氮气所含有的原子数目为NA
②4g金属钙变成钙离子时失去的电子数目为0.1NA
③在常温常压下,11.2L N2含有的分子数为0.5NA
④在标况下 1mol Ne含有的原子数为NA
⑤0.5mol单质铝的质量为13.5g
⑥标准状况下,1L水所含分子数为$\frac{1}{22.4}$NA
⑦17g氨气所含电子数目为10NA.
①28g氮气所含有的原子数目为NA
②4g金属钙变成钙离子时失去的电子数目为0.1NA
③在常温常压下,11.2L N2含有的分子数为0.5NA
④在标况下 1mol Ne含有的原子数为NA
⑤0.5mol单质铝的质量为13.5g
⑥标准状况下,1L水所含分子数为$\frac{1}{22.4}$NA
⑦17g氨气所含电子数目为10NA.
| A. | ①②⑤⑥⑦ | B. | ①②④⑤⑥ | C. | ⑤⑦ | D. | ④⑤⑦ |
10.设NA为阿伏加德罗常数,下列说法中,错误的是( )
| A. | 2.4g金属镁所含电子数目为0.2NA | |
| B. | 16gCH4所含原子数目为5NA | |
| C. | 17gNH3所含电子数目为10NA | |
| D. | 在常温常压下,11.2LN2含有的分子数为0.5NA |