题目内容
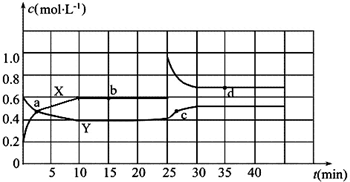
1. 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g)△H<0,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如图所示.
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g)△H<0,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如图所示.(1)前8分钟A的平均反应速率为0.08mol•L-1min-1
(2)X=1,反应达到第一个平衡时,K=4
(3)反应到30s时改变的条件是扩大容器体积,反应到40s时改变的条件是升高温度
(4)画出该反应的反应速率随时间变化的图象.
分析 (1)前8分钟A的浓度由2mol/L减少为1.36mol/L,根据v=$\frac{△c}{△t}$计算;
(2)由开始到达到平衡,A、B的浓度减少的量相同,由此可知X=1,从图可知平衡时各物质的浓度,根据化学平衡常数概念计算K;
(3)由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,该反应气体体积不变,应为降低了压强,40min时C的浓度降低,A、B浓度升高,反应逆向移动,正反应是放热反应,升高温度逆向移动;
(4)根据降低压强和升高温度对该反应速率的影响可得.
解答 解:(1)从图可知,前8分钟A的浓度由2mol/L减少为1.36mol/L,则v(A)=$\frac{2mol/L-1.36mol/L}{8min}$=0.08mol•L-1min-1;
故答案为:0.08mol•L-1min-;
(2)由开始到达到平衡,A、B的浓度减少的量相同,由此可知X=1,即反应为A(g)+B(g)?2C(g),由图可知20min达到平衡,K=$\frac{2^2}{1×1}$=4;
故答案为:1;4:
(3)由图象可知,30min时只有反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,该反应气体体积不变,应为降低了压强,故扩大容器体积,40min时C的浓度降低,A、B浓度升高,反应逆向移动,正反应是放热反应,升高温度逆向移动;
故答案为:扩大容器体积;升高温度;
(4)30min时,扩大容器体积,降低了压强,反应速率减慢,但平衡不移动,40min时升高温度,反应速率加快,平衡逆向移动,所以该反应的反应速率随时间变化的图象为: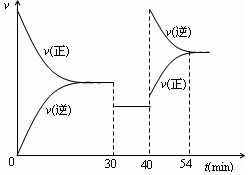 ,故答案为:
,故答案为: .
.
点评 本题考查了化学平衡的速率计算以及对化学平衡的影响因素,掌握基础,推出X的值是关键,题目难度不大.

| A. | 它们的体积之比为1:1 | B. | 它们所含氧原子数目之比为2:3 | ||
| C. | 它们的分子数目之比为1:1 | D. | 它们所含原子数目之比为3:4 |
| A. | 使用食品添加剂与提倡绿色食品相违背 | |
| B. | 含有食品添加剂的食品应该少食,以防中毒 | |
| C. | 没有加任何添加剂的天然食品是最安全的 | |
| D. | 食品添加剂在合理限量范围内不影响人体健康 |

| A. | 该反应的△H>0 | B. | 达平衡时,3v(H2)正=v(CO2)逆 | ||
| C. | a点对应的H2的平衡转化率为90% | D. | b点对应的平衡常数K值大于c点 |
 已知卤化银AgX的沉淀溶解平衡曲线如图所示,横坐标p(Ag+)=-lg(Ag+),纵坐标Y=-lg(X-),下列说法正确的是( )
已知卤化银AgX的沉淀溶解平衡曲线如图所示,横坐标p(Ag+)=-lg(Ag+),纵坐标Y=-lg(X-),下列说法正确的是( )| A. | 该温度下AgCl的Ksp约为1×10-15 | |
| B. | a点可表示AgCl的过饱和溶液 | |
| C. | b点时c(Ag+)=c(I-) | |
| D. | 该温度下,AgCl和AgBr饱和溶液中:c(Cl-)<c(Br-) |
某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(2)250s时,H2的转化率为30%.
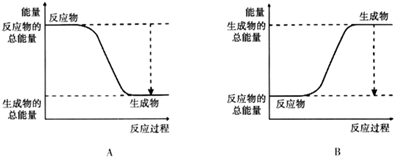
(3)已知N≡N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中的热量变化92 kJ.下图能正确表示该反应中能量变化的是A.
(4)为加快反应速率,可以采取的措施b
a.降低温度 b.增大压强 c.恒容时充入He气d.恒压时充入He气 e.及时分离NH3
(5)下列说法错误的是d
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.为了提高N2的转化率,应适当提高H2的浓度
d.250~350s生成物浓度保持不变,反应停止.
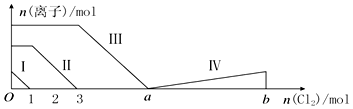
| A. | 线段Ⅱ表示Br-的变化情况 | |
| B. | 线段Ⅳ表示IO3-的变化情况,其中IO3-增加了5moL. | |
| C. | a=6 | |
| D. | 原溶液中n(FeI2):n(FeBr2)=3:1 |