题目内容
9.已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入一体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图.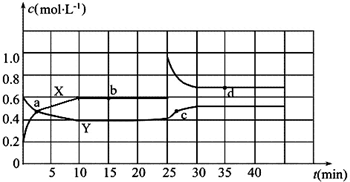
(1)图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d.
(2)①前10min内用NO2表示的化学反应速率v(NO2)=0.04mol•L-1•min-1.
②0~15min,反应2NO2(g)?N2O4(g)的平衡常数Kb=$\frac{10}{9}$.
③25min~35min时,反应2NO2(g)?N2O4(g)的平衡常数Kd=Kb(填“>”、“=”或“<”).
(3)反应25min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是增大NO2的浓度(用文字表达),若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25min时还可以采取的措施是B、D.
A.加入催化剂 B.缩小容器体积
C.升高温度 D.加入一定量的N2O4.
分析 (1)根据浓度的变化程度来判断,浓度的变化量之比等于化学方程式中的化学计量数之比,浓度变化较快的为NO2,即曲线X表示NO2浓度随时间的变化;当体系中物质的量浓度不再发生变化时,即达到平衡,所以b、d点为平衡点;
(2)①根据v=$\frac{△c}{△t}$计算前10min内用NO2表示的化学反应速率;
②根据化学平衡常数概念得反应2NO2(g)?N2O4(g)的平衡常数,再代入表中数据可得;
③反应在25 min~35 min时,N2O4 浓度逐渐增大,NO2 的浓度迅速增大后又逐渐减小,所以一定是增大NO2 的浓度,没有改变温度,温度不变,化学平衡常数K不变;
(3)根据图象25min,N2O4 浓度逐渐增大,NO2 的浓度迅速增大后又逐渐减小,所以一定是增大NO2 的浓度;要达到使NO2(g)的百分含量与d点相同的化学平衡状态,相当于增大压强,或者加入反应体系中的一种物质.
解答 解:(1)由图象可知,0~10min内,X曲线浓度变化△(X)为0.6mol/L-0.2mol/L=0.4mol/L,Y曲线浓度变化△(Y)为0.6mol/L-0.4mol/L=0.2mol/L,根据反应可知NO2和N2O4的浓度变化量之比为2:1,则曲线X表示NO2浓度随时间的变化;当体系中物质的量浓度不再发生变化时,即达到平衡,所以b、d点为平衡点;
故答案为:X;b和d;
(2)①由图象可知,0~10min内,X曲线浓度变化△(X)为0.6mol/L-0.2mol/L=0.4mol/L,则前10min内用NO2表示的化学反应速率v(NO2)=$\frac{0.4mol/L}{10min}$=0.04mol/(L•min);
故答案为:0.04;
②由图象可知,0~15min,反应是平衡的,平衡时c(NO2)=0.6mol/L,c(N2O4)=0.4mol/L,则反应2NO2(g)?N2O4(g)的平衡常数K=$\frac{0.4}{0.{6}^{2}}$=$\frac{10}{9}$;
故答案为:$\frac{10}{9}$;
③反应在25 min~35 min时,N2O4 浓度逐渐增大,NO2 的浓度迅速增大后又逐渐减小,所以一定是增大NO2 的浓度,没有改变温度,所以反应2NO2(g)?N2O4(g)的平衡常数Kd=Kb;
故答案为:=;
(3)根据图象可知25min时X浓度突然增大,Y浓度不变,说明增大了NO2的浓度;根据方程式的特点可知,要达到使NO2(g)的百分含量与d点相同的化学平衡状态,相当于增大压强,或者加入反应体系中的一种物质,增加NO2浓度相当于增大体系压强,所以也可以采取缩小容器的体积,B项正确,增大N2O4 的浓度也相当于增大压强,平衡正向移动,D项正确;答案选B、D.
故答案为:增大NO2的浓度;B、D.
点评 本题考查化学平衡的计算,涉及化学平衡图象、反应速率计算等知识,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握化学平衡常数、化学反应速率的概念及计算方法.

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案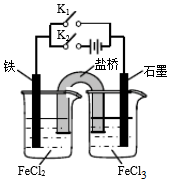
| A. | 闭合K1断开K2,左侧烧杯中的FeCl2溶液浓度逐渐增大 | |
| B. | 闭合K2断开K1,左侧烧杯中的Fe2+向铁电极移动 | |
| C. | 闭合K1断开K2,电流从石墨电极经过K1流向铁电极 | |
| D. | 无论闭合K1断开K2,还是断开K1闭合K2,石墨电极上发生的反应都是Fe3++e-=Fe2+ |
| A. | 蛋白质都能与浓硝酸发生显色反应 | |
| B. | 糖类不都能发生水解反应 | |
| C. | 油脂都不能使溴的四氯化碳溶液退色 | |
| D. | 水是营养物质 |
 NH3和CO2是两种重要的化工原料.
NH3和CO2是两种重要的化工原料.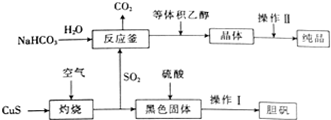 硫及其化合物在生产及生活中有着广泛的应用.
硫及其化合物在生产及生活中有着广泛的应用. 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g)△H<0,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如图所示.
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g)△H<0,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如图所示.