题目内容
2.将6.4gSO2和8.0gSO3相比较,下列结论中错误的是( )| A. | 它们的体积之比为1:1 | B. | 它们所含氧原子数目之比为2:3 | ||
| C. | 它们的分子数目之比为1:1 | D. | 它们所含原子数目之比为3:4 |
分析 结合n=$\frac{m}{M}$、V=nVm、N=nNA及分子构成计算.
解答 解:6.4gSO2和8.0gSO3的物质的量分别为$\frac{6.4g}{64g/mol}$=0.1mol、$\frac{8.0g}{80g/mol}$=0.1mol,
A.由V=nVm可知,Vm不确定,则它们的体积之比不一定为1:1,故A错误;
B.它们所含氧原子数目之比为0.1mol×2:0.1mol×3=2:3,故B正确;
C.由N=nNA可知,物质的量相同,则它们的分子数目之比为1:1,故C正确;
D.它们所含原子数目之比为0.1mol×3:0.1mol×4=3:4,故D正确;
故选A.
点评 本题考查物质的量的计算,为高频考点,把握质量、体积、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意物质的构成及基本计算公式的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.一定条件下,可逆反应N2+3H2?2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是( )
| A. | 加催化剂,v正、v逆都发生变化,且变化的倍数相等 | |
| B. | 加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数 | |
| C. | 降温,v正、v逆都减小,且v正减小的倍数大于v逆减小的倍数 | |
| D. | 增大氮气的浓度,v正增大、v逆不变,N2转化率减小,H2转化率增大 |
13.反应3Fe(s)+4H2O(g)═Fe3O4+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 增加Fe的物质的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 升高温度 | |
| D. | 压强不变,充入Ne使容器的体积增大 |
10.某同学为研究电化学原理,使用KCl盐桥设计如图所示实验装置.下列分析不合理的是( )
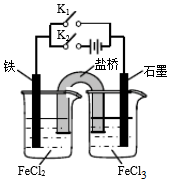

| A. | 闭合K1断开K2,左侧烧杯中的FeCl2溶液浓度逐渐增大 | |
| B. | 闭合K2断开K1,左侧烧杯中的Fe2+向铁电极移动 | |
| C. | 闭合K1断开K2,电流从石墨电极经过K1流向铁电极 | |
| D. | 无论闭合K1断开K2,还是断开K1闭合K2,石墨电极上发生的反应都是Fe3++e-=Fe2+ |
17.某溶液中含有Ag+、Ba2+、Mg2+离子,为了将这三种离子逐个进行沉淀分离,加入下列离子的先后顺序正确的是( )
| A. | CO32-、Cl-、OH- | B. | Cl-、OH-、CO32- | C. | OH-、Cl-、CO32- | D. | CO32-、OH-、Cl- |
7.下列过程中属于物理变化的是( )
| A. | 煤的燃烧 | B. | 碘的升华 | C. | 铜的锈蚀 | D. | 铝的冶炼 |
14.甲醇广泛用作燃料电池的燃料,可由天然气来合成,已知:
①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H=-71kJ/mol
②CO(g)+2H2(g)═CH3OH(l);△H=-90.5kJ/mol
③CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890kJ/mol
下列说法不正确的是( )
①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H=-71kJ/mol
②CO(g)+2H2(g)═CH3OH(l);△H=-90.5kJ/mol
③CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890kJ/mol
下列说法不正确的是( )
| A. | 三个反应均为放热反应,故不需要加热就能进行 | |
| B. | CO(g)+2H2(g)═CH3OH(g);△H>-90.5 kJ/mol | |
| C. | 甲醇的燃烧热为764 kJ/mol | |
| D. | 若CO的燃烧热为282.5 kJ/mol,则H2的燃烧热为286 kJ/mol |
 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g)△H<0,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如图所示.
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g)△H<0,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如图所示.