题目内容
13.工业合成氨的反应如下:N2(g)+3H2(g)?2NG3(g).某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(2)250s时,H2的转化率为30%.
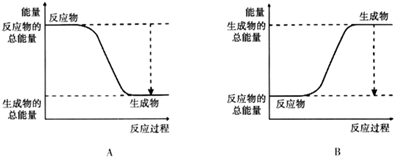
(3)已知N≡N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中的热量变化92 kJ.下图能正确表示该反应中能量变化的是A.
(4)为加快反应速率,可以采取的措施b
a.降低温度 b.增大压强 c.恒容时充入He气d.恒压时充入He气 e.及时分离NH3
(5)下列说法错误的是d
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.为了提高N2的转化率,应适当提高H2的浓度
d.250~350s生成物浓度保持不变,反应停止.
分析 (1)图表中0~50s内氨气的浓度变化为0.24mol,计算氨气的反应速率,速率之比等于化学方程式计量数之比计算得到氮气的反应速率;
(2)250s时,氨气生成的物质的量为0.40mol,则反应的氢气物质的量=0.6mol,转化率=$\frac{消耗量}{起始量}$×100%;
(3)反应焓变△H=反应物总键能-生成物总键能;依据焓变判断反应图象变化;
(4)升高温度、中等压强、增大浓度、加入催化剂、增加接触面积等措施都可以加快反应速率;
(5)氢气和氮气合成氨是可逆反应一定条件下达到平衡状态,为动态平衡,两种反应物增加一种会提高另一种的转化率,催化剂改变反应速率不改变化学平衡.
解答 解:(1)图表中0~50s内氨气的浓度变化为0.24mol,计算氨气的反应速率v(NH3)=$\frac{\frac{0.24mol}{2.0L}}{50s}$=0.0024mol/(L•s),v(NH3):v(N2)=2:1,v(N2)=$\frac{0.0024mol/(L•s)}{2}$=1.2×10-3mol/(L•s ),
故答案为:1.2×10-3mol/(L•s );
(2)250s时,氨气生成的物质的量为0.40mol,则反应的氢气物质的量=0.6mol,转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.6mol}{2.0mol}$×100%=30%,
故答案为:30%;
(3)已知N≡N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,N2(g)+3H2(g)?2NH3(g),生成1molNH3反应过程中能量变化=$\frac{1}{2}$×946KJ/moL+$\frac{3}{2}$×436KJ/mol-3×391kJ/mol=-92KJ/mol,则生成1molNH3过程中的热量变化位92KJ,反应为放热反应,反应物能量高于生成物的能量,反应为放热反应,正确表示该反应中能量变化的是选A,
故答案为:92;A;
(4)a.降低温度,反应速率减小,故a错误;
b.增大压强,反应速率增大,故b正确;
c.恒容时充入He气,总压增大,分压不变,平衡不变,反应速率不变,故c错误;
d.恒压时充入He气,体积增大,压强减小,反应速率减小,故d错误;
e.及时分离NH3 反应正向进行,难度减小反应速率减小,故e错误;
故答案为:b;
(5)a.使用催化剂是为了加快反应速率,缩短了反应达到平衡的时间,提高了生产效率,故a正确;
b.上述条件下,反应为可逆反应,N2不可能100%转化为NH3 ,故b正确;
c.为了提高N2的转化率,应适当提高H2的浓度,提高氮气的转化率,氢气转化率减小,故c正确;
d.250~350s生成物浓度保持不变,反应达到平衡状态,反应仍然进行.只是正逆反应速率相同,故d错误;
故答案为:d.
点评 本题考查了化学反应速率、化学平衡的影响因素分析判断、化学平衡移动原理的应用等知识,掌握基础是关键,题目难度中等.

 孟建平名校考卷系列答案
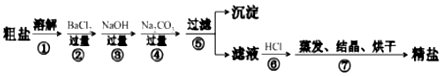
孟建平名校考卷系列答案①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H=-71kJ/mol
②CO(g)+2H2(g)═CH3OH(l);△H=-90.5kJ/mol
③CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890kJ/mol
下列说法不正确的是( )
| A. | 三个反应均为放热反应,故不需要加热就能进行 | |
| B. | CO(g)+2H2(g)═CH3OH(g);△H>-90.5 kJ/mol | |
| C. | 甲醇的燃烧热为764 kJ/mol | |
| D. | 若CO的燃烧热为282.5 kJ/mol,则H2的燃烧热为286 kJ/mol |
 催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO.反应的热化学方程式如下:
催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO.反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 I
CO2(g)+H2(g)?CO(g)+H2O(g)△H2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
已知:①CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1
②H2O(l)═H2O(g)△H3=44.0kJ•mol-1
请回答(不考虑温度对△H的影响):
(1)反应I的平衡常数表达式K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$;反应II的△H2=+41.2kJ•mol-1.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有CD.
A.使用催化剂Cat.1B.使用催化剂Cat.2C.降低反应温度
D.投料比不变,增加反应物的浓度 E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是表中数据表明此时未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响.
(4)在图中分别画出I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图.
(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在阴极,该电极反应式是CO2+6H++6e-=CH3OH+H2O.
(1)配制250ml0.1mol/L的盐酸溶液
| 应量取盐酸体积/ml | 应选用容量瓶的规格/ml | 除容量瓶外还需要的其它仪器 |
A.用30ml水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加少量水(约30ml),用玻璃棒慢慢搅动,使其混合均匀
C.将冷却的盐酸沿玻璃棒注入250ml的容量瓶中
D.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
E.将容量瓶盖紧,振荡,摇匀
F.改用胶头滴管加水,使溶液凹面恰好与刻度相切
(3)操作A中,将洗涤液均注入容量瓶,其目的是防止烧杯中的残留液没有移入容量瓶使溶液浓度减少.溶液注入容量瓶前需恢复到室温,这是因为盐酸溶解放热使溶液体积膨胀,不冷却会使溶液浓度增大..
(4)若实验过程中出现下列情况如何处理?
加蒸馏水时不慎超过了刻度重新配制;向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面重新配制.
 NH3和CO2是两种重要的化工原料.
NH3和CO2是两种重要的化工原料. 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g)△H<0,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如图所示.
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g)△H<0,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如图所示.