题目内容
15.锰的化合物种类较多,也大多具有广泛的用途.I.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性.某化学兴趣小组通过实验探究Mn O2的性质.
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是D.
A.把Mn02固体加入到稀盐酸中,观察是否有黄绿色气体生成
B.把Mn O2固体加入到H2O2溶液中,观察是否有气泡产生
C.Na2S03溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
D.FeS04溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
(2)为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL 0.2mol/L NaOH溶液、1mL水、1mL 0.1mol/L硫酸.现象记录如下:
| 试管编号 | 实验现象 |
| A | 溶液不变色 |
| B | 溶液缓慢变浅棕褐色 |
| C | 溶液迅速变棕褐色 |
②写出C试管中发生反应的离子方程式:2I-+MnO2+4H+═I2+Mn2++2H2O.
Ⅱ,铁酸锰( MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机.MnFe2O4的制备工艺流程如图:

已知Fe3+、Mn2+沉淀的pH为下表所示.
| 开始沉淀 | 完全沉淀 | |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
②步骤二中需控制pH的范围是PH≥10.4.
③步骤三中是否洗涤干净的判断方法是取最后一次洗涤液,做焰色反应,通过蓝色的钴玻璃观察无紫色出现,说明不含钾离子,洗涤干净.
分析 I.(1)A.二氧化锰与浓盐酸在加热的条件下才反应,把Mn02固体加入到稀盐酸中不反应;
B.Mn O2固体加入到H2O2溶液中,Mn O2催化H2O2分解生成氧气;
C.Na2S03溶液中,加入MnO2固体,再滴加BaCl2溶液,即使MnO2固体不把Na2S03氧化成Na2S04,再滴加BaCl2溶液也可以与Na2S03溶液生成白色亚硫酸钡沉淀;
D.三价铁离子和KSCN溶液反应:Fe3++3SCN-?Fe(SCN)3颜色为血红色,二价铁与KSCN溶液不显色;
(2)①碘单质在水中的颜色为棕褐色,二氧化锰氧化碘离子生成单质碘,碘浓度越大,颜色越深;
②在酸性条件下MnO2氧化I-,二氧化锰被还原成+2价的锰离子,碘离子被还原成单质碘,据此书写离子方程式;
Ⅱ.①由MnFe2O4中可知:Fe和Mn的个数之比为1:2,根据质量守恒,求出原料Fe(NO3)n和Mn(NO3)2的物质的量之比;
②由工艺流程可知,加入KOH调节PH值,使Fe3+、Mn2+转化为Fe(OH)3、Mn(OH)2,根据Fe3+、Mn2+开始沉淀与沉淀完全的pH选择;
③沉淀可能附着KOH等,洗涤干净根据检验最后一次洗涤液中无钾离子即可.
解答 解:I.(1)A.二氧化锰与浓盐酸反应需在加热的条件下,稀盐酸且常温,不反应,故A错误;
B.Mn O2固体加入到H2O2溶液中,Mn O2催化H2O2分解生成氧气,则MnO2作催化剂不能验证MnO2的氧化性,故B错误;
C.把Na2SO3溶液再加入BaCl2溶液,有白色沉淀亚硫酸钡生成,所以MnO2固体加入与否无关,故C错误;
D.FeS04溶液中滴加几滴KSCN溶液,再加入MnO2固体,如果二氧化锰具有氧化性,将+2价的铁氧化成+3价的铁,三价铁离子和KSCN溶液反应:Fe3++3SCN-?Fe(SCN)3颜色为血红色,所以观察溶液是否变红可判断,故D正确;
故选D.
(2)①该小组从上述对比实验中,碘浓度越大,颜色越深,说明生成的碘越多,与此对应的条件是酸性强,所以从以上实验中,我们可以得出的结论是
酸性越强,MnO2氧化性越强,故答案为:酸性越强,MnO2氧化性越强;
②在酸性条件下MnO2氧化I-,二氧化锰被还原成+2价的锰离子,碘离子被还原成单质碘,所以离子方程式为:2I-+MnO2+4H+═I2+Mn2++2H2O,
故答案为:2I-+MnO2+4H+═I2+Mn2++2H2O;
Ⅱ.①由MnFe2O4组成可知:Fe和Mn的个数之比为2:1,根据质量守恒可知,Fe(NO3)n与Mn(NO3)2 二者之比 2:1.
故答案为:2:1;
②由工艺流程可知,加入KOH调节PH值,使Fe3+、Mn2+转化为Fe(OH)3、Mn(OH)2,Fe3+在PH=2.7开始沉淀,PH=4.2沉淀完全,Mn2+在PH=8.3开始沉淀,PH=10.4沉淀完全,保证Fe3+、Mn2+都完全沉淀,应控制PH≥10.4;
故答案为:PH≥10.4;
③沉淀可能附着KOH等,取最后一次洗涤液,做焰色反应,通过蓝色的钴玻璃观察无紫色出现,说明不含钾离子,洗涤干净;
故答案为:取最后一次洗涤液,做焰色反应,通过蓝色的钴玻璃观察无紫色出现,说明不含钾离子,洗涤干净.
点评 本题以MnFe2O4的制备为载体,考查学生对工艺流程的理解、对实验操作的理解、化学式有关计算以及MnO2的氧化能力的探究等,难度中等,综合性较强,涉及的知识点多,需要学生具备阅读分析能力和灵活运用知识的解决问题能力.

| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s22s22p63s23p4,原子半径最大的是① | |
| B. | 下列原子的价电子排布中,①3s23p1②3s23p2③3s23p3 ④3s23p4,对应的第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数的增加而递增的是④ | |
| D. | 某元素的逐级电离能(kJ•mol-1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时最可能生成的阳离子是X3+ |
| A. | CH2═CH-CH═CH21,3-二丁烯 | B. | CH2BrCH2Br 二溴乙烷 | ||
| C. | CH3CH2CH(OH)CH33-丁醇 | D. |  2-甲基丁烷 2-甲基丁烷 |
| A. | 正丁烷和异丁烷 | B. | 淀粉和纤维素 | ||
| C. |  | D. | CH3CH2COOH和CH3COOCH3 |
| A. | 7.8gNa2O2中含有的阴离子数目为0.2Na | |
| B. | 标准状况下,2.24LCHCl3的分子数为0.1NA | |
| C. | 0.1molFe与足量稀HNO3反应,转移电子数为0.3NA | |
| D. | 1L 0.1mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA |
 香柠檬油是从香柠檬树的果皮中提炼的橘子味的香油,33%的女用香水用到了这种原料.香柠檬油含微量的香柠檬酚和香柠檬醚,其结构如图.下列说法正确的是( )
香柠檬油是从香柠檬树的果皮中提炼的橘子味的香油,33%的女用香水用到了这种原料.香柠檬油含微量的香柠檬酚和香柠檬醚,其结构如图.下列说法正确的是( )| A. | 香柠檬醚的分子式为C13H6O4 | |
| B. | 香柠檬酚可与甲酸反应转化成香柠檬醚 | |
| C. | 1 mol香柠檬酚最多可与2 mol Br2发生反应 | |
| D. | 1 mol香柠檬酚最多可以与3 mol NaOH溶液反应 |
| A. | 甲烷分子的比例模型: | B. | 羟基电子式: | ||
| C. | 间二甲苯的结构简式: | D. | 乙烯的实验式:CH2 |
| A. | 加入过量氨水,有白色沉淀生成,则原溶液中一定有Al3+ | |
| B. | 加入NaOH溶液然后加热,产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定有NH4+ | |
| C. | 加入用硝酸酸化的BaCl2溶液后有白色沉淀生成,则该无色溶液中一定含有Ag+ | |
| D. | 加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液中一定有SO42- |
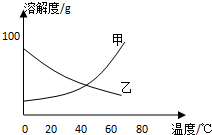 甲、乙两种固体纯净物的溶解度曲线如图所示.在常温下,先在两支试管里分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里.下列说法正确的是( )
甲、乙两种固体纯净物的溶解度曲线如图所示.在常温下,先在两支试管里分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里.下列说法正确的是( )| A. | 乙溶液中溶质的质量分数增大 | B. | 装甲溶液的试管中剩余的固体减少 | ||
| C. | 试管里甲、乙物质的溶解度都增大 | D. | 两支试管里剩余的固体都增多 |