题目内容
7.下列化学用语正确的是( )| A. | 甲烷分子的比例模型: | B. | 羟基电子式: | ||
| C. | 间二甲苯的结构简式: | D. | 乙烯的实验式:CH2 |
分析 A、 为甲烷的球棍模型;
为甲烷的球棍模型;
B、-OH中有一个孤对电子;
C、间二甲苯中两个甲基是间位的关系;
D、实验式是各原子的最简单的整数比.
解答 解:A、甲烷分子的比例模型应该体现出甲烷分子中各原子的相对体积大小, 为甲烷的球棍模型,甲烷的比例模型为:
为甲烷的球棍模型,甲烷的比例模型为: ,故A错误;
,故A错误;
B、-OH中有一个孤对电子,不显电性,故电子式为 ,故B错误;
,故B错误;
C、间二甲苯中两个甲基是间位的关系,故结构简式为 ,故C错误;
,故C错误;
D、实验式是各原子的最简单的整数比,由于乙烯的分子式为C2H4,故最简式为CH2,故D正确.
故选D.
点评 本题考查了化学用语,涉及结构简式、离子结构示意图、电子式等知识点,根据这些化学用语特点来分析解答,注意-OH电子式的书写,为易错点.

练习册系列答案
相关题目
8.下列各组物质属同素异形体的是( )
| A. | 金刚石、石墨和C60 | B. | 16O和18O | ||
| C. | O2和SO3 | D. | H2O和H2O2 |
15.锰的化合物种类较多,也大多具有广泛的用途.
I.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性.某化学兴趣小组通过实验探究Mn O2的性质.
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是D.
A.把Mn02固体加入到稀盐酸中,观察是否有黄绿色气体生成
B.把Mn O2固体加入到H2O2溶液中,观察是否有气泡产生
C.Na2S03溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
D.FeS04溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
(2)为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL 0.2mol/L NaOH溶液、1mL水、1mL 0.1mol/L硫酸.现象记录如下:
①从以上实验中,我们可以得出的结论是酸性越强,MnO2氧化性越强.
②写出C试管中发生反应的离子方程式:2I-+MnO2+4H+═I2+Mn2++2H2O.
Ⅱ,铁酸锰( MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机.MnFe2O4的制备工艺流程如图:

已知Fe3+、Mn2+沉淀的pH为下表所示.
①步骤一中投入原料Fe(NO3)3和Mn(N03)2的物质的量之比理论上应为2:1.
②步骤二中需控制pH的范围是PH≥10.4.
③步骤三中是否洗涤干净的判断方法是取最后一次洗涤液,做焰色反应,通过蓝色的钴玻璃观察无紫色出现,说明不含钾离子,洗涤干净.
I.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性.某化学兴趣小组通过实验探究Mn O2的性质.
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是D.
A.把Mn02固体加入到稀盐酸中,观察是否有黄绿色气体生成
B.把Mn O2固体加入到H2O2溶液中,观察是否有气泡产生
C.Na2S03溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
D.FeS04溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
(2)为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL 0.2mol/L NaOH溶液、1mL水、1mL 0.1mol/L硫酸.现象记录如下:
| 试管编号 | 实验现象 |
| A | 溶液不变色 |
| B | 溶液缓慢变浅棕褐色 |
| C | 溶液迅速变棕褐色 |
②写出C试管中发生反应的离子方程式:2I-+MnO2+4H+═I2+Mn2++2H2O.
Ⅱ,铁酸锰( MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机.MnFe2O4的制备工艺流程如图:

已知Fe3+、Mn2+沉淀的pH为下表所示.
| 开始沉淀 | 完全沉淀 | |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
②步骤二中需控制pH的范围是PH≥10.4.
③步骤三中是否洗涤干净的判断方法是取最后一次洗涤液,做焰色反应,通过蓝色的钴玻璃观察无紫色出现,说明不含钾离子,洗涤干净.
2.2002年12月26日,俄罗斯特种部队使用强力麻醉剂芬太奴(Fentanyl)和氟烷(Halothane).下列有关氟烷(CHClBr-CF3)说法正确的是( )
| A. | 该氟烷易溶于水,也易溶于有机溶剂 | |
| B. | 该氟烷扩散到空气中能破坏臭氧层 | |
| C. | 该氟烷密度比水小 | |
| D. | 与该氟烷互为同分异构体的氟烷(不含本身)有三种 |
12.向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况(不计CO2的溶解),则下列对应图形的判断正确的是( )
| A. |  含有两种溶质 | B. |  只含一种溶质 | ||
| C. |  只含Na2CO3 | D. |  含有Na2CO3和 NaHCO3 |
19.全国禁止在中小学幼儿园内吸烟,杜绝学生吸食“二手烟”.造成非吸烟者在公共场所吸食“二手烟”的主要原因是( )
| A. | 分子很小 | B. | 分子之间有间隙 | C. | 分子在不断运动 | D. | 分子由原子构成 |
16.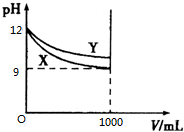 常温下pH=12的X、Y两种碱溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示.下列说法正确的是( )
常温下pH=12的X、Y两种碱溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示.下列说法正确的是( )
 常温下pH=12的X、Y两种碱溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示.下列说法正确的是( )
常温下pH=12的X、Y两种碱溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示.下列说法正确的是( )| A. | X是弱碱,Y是强碱 | |
| B. | X、Y两种溶液稀释前溶质的物质的量浓度相等 | |
| C. | 两种溶液稀释后恢复至原温度,溶液中c(H+)与c(OH-)之比都变大 | |
| D. | 两种溶液稀释后恢复至原温度,溶液中c(H+)与c(OH-)的乘积都变小 |
 的系统名称是2,2,6-三甲基-4-乙基辛烷.
的系统名称是2,2,6-三甲基-4-乙基辛烷.