题目内容
6.下列各化合物的命名正确的是( )| A. | CH2═CH-CH═CH21,3-二丁烯 | B. | CH2BrCH2Br 二溴乙烷 | ||
| C. | CH3CH2CH(OH)CH33-丁醇 | D. |  2-甲基丁烷 2-甲基丁烷 |
分析 判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:
1)命名要符合“一长、一近、一多、一小”,也就是主链最长,编号起点离支链最近,支链数目要多,支链位置号码之和最小;
2)有机物的名称书写要规范;
3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名.
4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.
解答 解:A.选同时包含两个双键的碳链做主链,名称为1,3-丁二烯,故A错误;
B.从距离官能团近的一端编号,应为:1,2-二溴乙烷,故B错误;
C.该物质要从离羟基近的一端编号,正确的名称为2-丁醇,故C错误;
D.最长碳链四个,离取代基近的一端编号,名称为2-甲基丁烷,名称符合命名规则,故D正确.
故选D.
点评 本题考查了有机物的命名知识,题目难度不大,一般要求了解烷烃的命名、烯烃的命名、卤代烃命名、醇的命名,命名时要遵循命名原则,书写要规范.

练习册系列答案
相关题目
7.胶体区别于其它分散系的特征是( )
| A. | 胶体粒子能够发生布朗运动 | B. | 胶体粒子带电荷 | ||
| C. | 胶体粒子直径在1-100nm之间 | D. | 胶体粒子不能穿过半透膜 |
8.下列各组物质属同素异形体的是( )
| A. | 金刚石、石墨和C60 | B. | 16O和18O | ||
| C. | O2和SO3 | D. | H2O和H2O2 |
1.下列液体均处于25℃,有关叙述正确的是( )
| A. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 25℃时,用pH试纸测定出某醋酸溶液的pH=3.50 | |
| D. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在:K+、Na+、AlO2-、SO42- |
15.锰的化合物种类较多,也大多具有广泛的用途.
I.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性.某化学兴趣小组通过实验探究Mn O2的性质.
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是D.
A.把Mn02固体加入到稀盐酸中,观察是否有黄绿色气体生成
B.把Mn O2固体加入到H2O2溶液中,观察是否有气泡产生
C.Na2S03溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
D.FeS04溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
(2)为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL 0.2mol/L NaOH溶液、1mL水、1mL 0.1mol/L硫酸.现象记录如下:
①从以上实验中,我们可以得出的结论是酸性越强,MnO2氧化性越强.
②写出C试管中发生反应的离子方程式:2I-+MnO2+4H+═I2+Mn2++2H2O.
Ⅱ,铁酸锰( MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机.MnFe2O4的制备工艺流程如图:

已知Fe3+、Mn2+沉淀的pH为下表所示.
①步骤一中投入原料Fe(NO3)3和Mn(N03)2的物质的量之比理论上应为2:1.
②步骤二中需控制pH的范围是PH≥10.4.
③步骤三中是否洗涤干净的判断方法是取最后一次洗涤液,做焰色反应,通过蓝色的钴玻璃观察无紫色出现,说明不含钾离子,洗涤干净.
I.MnO2是H2O2分解的良好的催化剂,它也具有较强的氧化性.某化学兴趣小组通过实验探究Mn O2的性质.
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是D.
A.把Mn02固体加入到稀盐酸中,观察是否有黄绿色气体生成
B.把Mn O2固体加入到H2O2溶液中,观察是否有气泡产生
C.Na2S03溶液中,加入MnO2固体,再滴加BaCl2溶液,观察是否有白色沉淀生成
D.FeS04溶液中滴加几滴KSCN溶液,再加入MnO2固体,观察溶液是否变红
(2)为研究溶液中MnO2的氧化能力与溶液酸碱性的关系,该小组同学设计了如下的对比实验:在室温下,取A、B、C三支试管,用同浓度同体积的KI溶液和质量、颗粒大小相同的MnO2固体反应,然后分别加入1mL 0.2mol/L NaOH溶液、1mL水、1mL 0.1mol/L硫酸.现象记录如下:
| 试管编号 | 实验现象 |
| A | 溶液不变色 |
| B | 溶液缓慢变浅棕褐色 |
| C | 溶液迅速变棕褐色 |
②写出C试管中发生反应的离子方程式:2I-+MnO2+4H+═I2+Mn2++2H2O.
Ⅱ,铁酸锰( MnFe2O4)可用于热化学循环分解水制氢,可有效缓解能源危机.MnFe2O4的制备工艺流程如图:

已知Fe3+、Mn2+沉淀的pH为下表所示.
| 开始沉淀 | 完全沉淀 | |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
②步骤二中需控制pH的范围是PH≥10.4.
③步骤三中是否洗涤干净的判断方法是取最后一次洗涤液,做焰色反应,通过蓝色的钴玻璃观察无紫色出现,说明不含钾离子,洗涤干净.
16.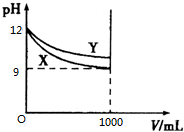 常温下pH=12的X、Y两种碱溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示.下列说法正确的是( )
常温下pH=12的X、Y两种碱溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示.下列说法正确的是( )
 常温下pH=12的X、Y两种碱溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示.下列说法正确的是( )
常温下pH=12的X、Y两种碱溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示.下列说法正确的是( )| A. | X是弱碱,Y是强碱 | |
| B. | X、Y两种溶液稀释前溶质的物质的量浓度相等 | |
| C. | 两种溶液稀释后恢复至原温度,溶液中c(H+)与c(OH-)之比都变大 | |
| D. | 两种溶液稀释后恢复至原温度,溶液中c(H+)与c(OH-)的乘积都变小 |
 .
. 的系统名称是2,2,6-三甲基-4-乙基辛烷.
的系统名称是2,2,6-三甲基-4-乙基辛烷.