题目内容
2.将一铜棒、碳棒用导线连接后,插入内盛20%氯化钠溶液的U形管中,请根据此装置在下列两项中择一回答:①若不是原电池,请说明原因:不能发生自发的氧化还原反应,故不能形成原电池(如果回答此题,下面的②不用回答)
②若是原电池,现要求利用此装置(电极材料、溶液浓度均不变),采取适当的措施来提高池的放电效率,该操作可以是..
分析 铜棒和碳棒作电极,氯化钠作为电解质溶液,形成闭合回路后,不能发生自发的氧化还原反应,故不能形成原电池.
解答 解:铜棒和碳棒作电极,氯化钠作为电解质溶液,形成闭合回路后,不能发生自发的氧化还原反应,故不能形成原电池,
故答案为:不能发生自发的氧化还原反应,故不能形成原电池.
点评 考查了原电池的基本原理,能够自发进行的氧化还原反应能设计成原电池,题目较基础.

练习册系列答案
相关题目
12.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 等物质的量的O2和CO2所含氧原子数均为2NA | |
| B. | 标准状况下,2.24 L一氯甲烷中含有氢原子数目为0.3NA | |
| C. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA | |
| D. | 6.8 g熔融的KHSO4中含有0.1 NA个阳离子 |
13.某种微生物电池,其工作原理示意图如图,下列说法不正确的是( )
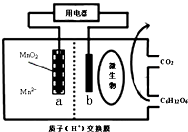

| A. | H+向左移动 | |
| B. | 电子由a极沿导线流向b极 | |
| C. | b极电极反应式为:C6H12O6-24e-+6H2O=6CO2+24H+ | |
| D. | 当电路中转移0.2mole-时,a极质量减少8.7g |
10.下列依据相关实验得出的结论正确的是( )
| 选项 | 实验操作和现象 | 实验结论 |
| A | 将SO2通入Ba(NO3)2溶液中,溶液变浑浊 | 生成BaSO3沉淀 |
| B | 点燃CO还原Fe2O3后的尾气,气体未能燃烧 | CO已完全反应 |
| C | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 向鸡蛋清溶液中加入少量CuSO4溶液,出现浑浊 | 蛋白质发生了盐析 |
| A. | A | B. | B | C. | C | D. | D |
17.X和Y均为短周期元素,已知aXn-比bYm+多两个电子层,下列说法正确的是( )
| A. | b<2 | B. | X只能位于第三周期 | ||
| C. | a+n-b+m=10或16 | D. | Y不可能位于第二周期 |
11.下列有机物命名正确的是( )
| A. | 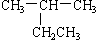 2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2CH2CH2OH 4-丁醇 | ||
| C. | 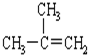 2-甲基-2-丙烯 2-甲基-2-丙烯 | D. | 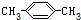 对二甲苯 对二甲苯 |
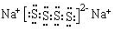 .
.