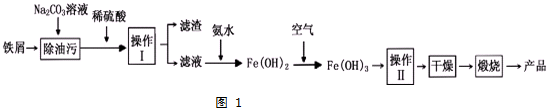
题目内容
11.下列有机物命名正确的是( )| A. |  2-乙基丙烷 2-乙基丙烷 | B. | CH3CH2CH2CH2OH 4-丁醇 | ||
| C. |  2-甲基-2-丙烯 2-甲基-2-丙烯 | D. |  对二甲苯 对二甲苯 |
分析 A、烷烃命名时,要选择最长的碳链为主链,从离支链近的一端给主链上碳原子进行编号;
B、醇命名时,选含官能团的最长的碳链为主链,从离官能团近的一端给主链上碳原子编号;
C、烯烃命名时,选含官能团的最长的碳链为主链,从离官能团近的一端给主链上碳原子编号;
D、苯的同系物命名时,根据侧链的位置关系来分析.
解答 解:A、烷烃命名时,要选择最长的碳链为主链,故主链上有4个碳原子,故为丁烷,从离支链近的一端给主链上碳原子进行编号,故在2号碳原子上有一个甲基,故名称为2-甲基丁烷,故A错误;B、醇命名时,选含官能团的最长的碳链为主链,故主链上有4个碳原子,为丁醇,从离官能团近的一端给主链上碳原子编号,故在1号碳原子上有-OH,故为1-丁醇,故B错误;
C、烯烃命名时,选含官能团的最长的碳链为主链,故主链上有3个碳原子,为丙烯,从离官能团近的一端给主链上碳原子编号,故在1号和2号碳原子间有碳碳双键,在2号碳原子上有一个甲基,故名称为2-甲基-1丙烯,故C错误;
D、此有机物中,两个甲基位于苯环的对位关系,故为对二甲苯,故D正确.
故选D.
点评 本题考查了烷烃、烯烃、醇和苯的同系物的命名,难度不大,应注意的是含官能团的有机物在命名时,要选含官能团的最长碳链为主链.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
4.工业合成尿素反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率与B点的逆反应速率的关系:v正(CO2)>v逆(CO2)(填“>”、“<”或“=”)

(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)?NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
①关于上述反应的焓变、熵变说法正确的是A
A.△H<0,△S<0B.△H>0,△S<0
C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
(3)化学家正在研究尿素动力燃料电池,尿液也能发电.用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率与B点的逆反应速率的关系:v正(CO2)>v逆(CO2)(填“>”、“<”或“=”)

(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)?NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.△H<0,△S<0B.△H>0,△S<0
C.△H>0,△S>0D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
(3)化学家正在研究尿素动力燃料电池,尿液也能发电.用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
5.硼在化合物中一般显正价.可用下述方法合成储氢材料氨硼烷:LiBH4+NH4Cl=NH3BH3+LiCl+H2↑.NH3BH3在催化剂存在时可以与水发生催化脱氢反应:NH3BH3+2H2O$\frac{\underline{\;催化剂\;}}{\;}$NH4BO2+3H2↑.下列有关说法正确的是( )
| A. | NH3BH3中H元素均为+1价 | |
| B. | 合成反应中每生成1 mol NH3BH3会转移2 mol e- | |
| C. | 两个反应中,H2均既是氧化产物,又是还原产物 | |
| D. | 0.1 mol NH3BH3发生上述催化脱氢反应,一定生成6.72 L H2 |
6.下列关于化学平衡的说法中,正确的是( )
| A. | 当达到化学平衡时,反应物已完全转化为生成物 | |
| B. | 化学平衡是一定条件下的平衡,当条件改变时,平衡可能会遭到破坏 | |
| C. | 当达到化学平衡时,反应混合物中各成分的浓度相等 | |
| D. | 当达到化学平衡时,正逆反应均已停止 |
16.草酸钴用途广泛,可用于指示剂和催化剂的制备.一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如图1:
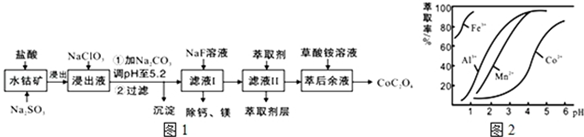
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原(填离子符号).
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去溶液中的Mn2+;使用萃取剂适宜的pH是B.
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去溶液中的Mn2+;使用萃取剂适宜的pH是B.
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.
20.“电池新贵”铝电池是用石墨作为正极材料,用有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作为电解液的二次电池,电池充电快、容量高、成本低、也很安全.已知该电池工作的过程中不产生其他离子且有机阳离子不参与电极反应,则下列说法正确的是( )
| A. | 电池工作时,有机阳离子通过外电路移向石墨电极 | |
| B. | 若用该电池给钢制品表面电镀Al,则钢制品应该接电池的正极 | |
| C. | 电池充电时,阴极的电极反应式为4Al2Cl7-+3e-=Al+7AlCl4- | |
| D. | 若改用NaOH溶液作电解液,则Al电极的反应式为Al-3e-+3OH-=Al(OH)3↓ |
1.氮化钛(Ti3N4)为金黄色晶体,是市售仿金品的重要成份.以TiCl4为原料,经过一系列反应(见图1)可以制得Ti3N4和纳米TiO2.
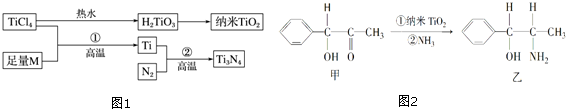
①基态Ti3+中未成对电子数有1个;与Ti同族下一周期元素Zr的基态原子的外围电子排布式为4d25s2;钛元素最高化合价为+4.
②图1中的M是短周期金属元素,M的部分电离能如下表.
M是Mg (填元素符号),该金属晶体的堆积模型为A3型最密堆积又称六方最密堆积.
③纳米TiO2是一种应用广泛的催化剂,某有机反应如图2所示.甲分子中采取sp2杂化的碳原子有7个,乙分子中采取sp3杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.

①基态Ti3+中未成对电子数有1个;与Ti同族下一周期元素Zr的基态原子的外围电子排布式为4d25s2;钛元素最高化合价为+4.
②图1中的M是短周期金属元素,M的部分电离能如下表.
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1 451 | 7 733 | 10 540 | 13 630 |
③纳米TiO2是一种应用广泛的催化剂,某有机反应如图2所示.甲分子中采取sp2杂化的碳原子有7个,乙分子中采取sp3杂化的原子对应的元素的电负性由大到小的顺序为O>N>C.