��Ŀ����
4���⻯ﮣ�LiH���ڸ���Ŀ��������ȶ����ڣ���ˮ�����ܹ�����ȼ�գ�ij�С����ʹ������װ���Ʊ�LiH���壮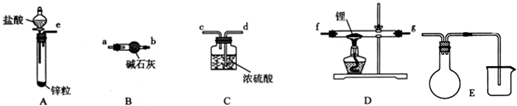
��ͬѧ��ʵ�鷽�����£�
��1����������װ���ӣ���������װ�ýӿڵ�����˳��Ϊe��a��b��f��g��d��f��g����Ҳ���ԣ�������ҩƷǰ����Ҫ���е�ʵ������Ǽ���װ�������ԣ�����д������IJ���������������װ��B�������dz�ȥH2�е�H2O��HCl��
��2������ҩƷ�������Ӵ��Լ�ƿ��ȡ��һ��������ﮣ�����ʯ���ܷ⣩��Ȼ���ڼױ��н�ϴ���Σ��ò�����Ŀ���dz�ȥﮱ����ʯ����Ȼ����ٰ�﮷��뵽ʯӢ���У�
��3��ͨ��һ��ʱ�����������ʯӢ�ܣ��ڼ���D����ʯӢ��֮ǰ��������е�ʵ��������ռ�c���ų������岢����H2���ȣ�
��4������һ��ʱ���ֹͣ���ȣ�����ͨ������ȴ��Ȼ��ȡ��LiH��װ�뵪���ƿ������ڰ�������ȡ����������Ŀ����Ϊ�˱���LiH������е�ˮ�����Ӵ�������Σ�գ�����Ӧ����ʽ��LiH+H2O=LiOH+H2�����������÷�Ӧԭ�������LiH����ˮ�Ҵ���Ӧ�Ļ�ѧ����ʽLiH+CH3CH2OH=CH3CH2OLi+H2����
��5��ȷ�����ƵõIJ�Ʒ0.174g����һ��������������ˮ��Ӧ���ռ�������470.4mL���ѻ���ɱ�״���������Ʒ��LiH��Li�����ʵ���֮��Ϊ10��1��
��6����ͬѧ�Լ�ʵ�鷽��������ɣ�����Ϊδ��Ӧ��H2����ֱ���ŷţ����������������װ��E�����ռ�H2���뽫Eװ�ò���������
���� ��1��������﮷�����Ӧ����LiH���Ʊ�LiH������Ҫ�Ʊ�������LiH�ڸ���Ŀ��������ȶ����ڣ���ˮ�����ܹ�����ȼ�գ������Ʊ��õ�������������﴿��������Aװ���Ʊ���������װ��B�еļ�ʯ�ҳ�ȥ�����е��Ȼ����ˮ������ͨ��װ��D�м��Ⱥ�﮷�Ӧ�����⻯ﮣ��������װ��C����ֹ�����е�ˮ�����Ͷ�����̼����װ��D�����ɵ��⻯﮷�����Ӧ��
�Ʊ�����װ�ã�����ҩƷǰ����Ҫ���е�ʵ������ǣ�����װ�������ԣ�
��2��ʯ�����л�����ܽ����л��ܼ��ױ���
��3��ʹ��ǰӦͨ��һ��ʱ���������ž�װ���ڵĿ�������ֹ����ʱ��������������ըΣ�գ�
��4��LiH��H2O����ˮ�ⷴӦ������ӽ�����������ӣ��⸺�����������ӽṹ����������LiH���Ҵ���Ӧ���ƣ��ǻ��ṩHԭ����LiH��Ӧ�������������ⲿ�ֽ������CH3CH2OLi��
��5����LiH��Li�����ʵ����ֱ�Ϊxmol��ymol�����ݷ���ʽ��ʾ���������������ʵ������ٸ��ݶ���������������������з��̼�����
��6��װ��E�����ռ�H2�����õ�������ƿ���ռ����������Ը�����ˮ���������װ�ã������ܶ̽�������
��� �⣺��1��������﮷�����Ӧ����LiH���Ʊ�LiH������Ҫ�Ʊ�������LiH�ڸ���Ŀ��������ȶ����ڣ���ˮ�����ܹ�����ȼ�գ������Ʊ��õ�������������﴿��������Aװ���Ʊ���������װ��B�еļ�ʯ�ҳ�ȥ�����е��Ȼ����ˮ������ͨ��װ��D�м��Ⱥ�﮷�Ӧ�����⻯ﮣ��������װ��C����ֹ�����е�ˮ�����Ͷ�����̼����װ��D�����ɵ��⻯﮷�����Ӧ��װ������˳��Ϊ��e��a��b��f��g��d��f��g����Ҳ���ԣ���
�Ʊ�����װ�ã�����ҩƷǰ����Ҫ���е�ʵ������ǣ�����װ�������ԣ�
װ��B�м�ʯ���������ƺ��������ƵĻ�����������ˮ�ɷ�Ӧ���������ƿ�������������������ܷ�Ӧ�����Ը�װ�õ�����������ˮ�����Ͳ����Ȼ������壬
�ʴ�Ϊ��e��a��b��f��g��d��f��g����Ҳ���ԣ�������װ�������ԣ���ȥH2�е�H2O��HCl��
��2��ȡ��һ��������ﮣ�����ʯ���ܷ⣩��Ȼ���ڼױ��н�ϴ���Σ�����ʯ�����л������ܽ����л��ܼ��ױ��У�������Ŀ���dz�ȥﮱ����ʯ����
�ʴ�Ϊ����ȥﮱ����ʯ����
��3��ʹ��ǰӦͨ��һ��ʱ���������ž�װ���ڵĿ�������ֹ����ʱ��������������ըΣ�գ��ڼ���D����ʯӢ��֮ǰ��������е�ʵ������ǣ��ռ�c���ų������岢����H2���ȣ�
�ʴ�Ϊ���ռ�c���ų������岢����H2���ȣ�
��4��LiH��H2O����ˮ�ⷴӦ������ӽ�����������ӣ��⸺�����������ӽṹ����������LiH���Ҵ���Ӧ���ƣ��ǻ��ṩHԭ����LiH��Ӧ�������������ⲿ�ֽ������CH3CH2OLi����Ӧ����ʽΪ��LiH+CH3CH2OH=CH3CH2OLi+H2����
�ʴ�Ϊ��LiH+CH3CH2OH=CH3CH2OLi+H2����
��5����LiH��Li�����ʵ����ֱ�Ϊxmol��ymol����
LiH+H2O=H2��+LiOH
xmol xmol
2Li+2H2O=2LiOH+H2��
ymol 0.5y mol
$\left\{\begin{array}{l}{8x+7y=0.174g}\\{x+0.5y=\frac{0.4704L}{22.4L/mol}}\end{array}\right.$���x=0.02��y=0.002
��LiH��Li�����ʵ���֮��Ϊ0.02mol��0.002mol=10��1��
�ʴ�Ϊ��10��1��
��6��װ��E�����ռ�H2�����õ�������ƿ���ռ����������Ը�����ˮ���������װ�ã������ܶ̽�������װ��ͼΪ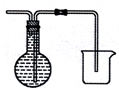 ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼�黯ѧʵ���Ʊ�����������ԭ���ǽ���ؼ����漰��װ�ü������ķ������ۡ������ռ�����ѧ����ʽ�ļ���ȣ���Ŀ�Ѷ��еȣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | ��� | B�� | ���ʯ��ʯ��ʯӢɰ | ||
| C�� | �����ʯ��ʯ | D�� | �������衢����ơ������� |
| A�� | ƽ��������Ӧ�����ƶ� | B�� | m+n��p | ||
| C�� | ����A��ת�������� | D�� | C���������������� |
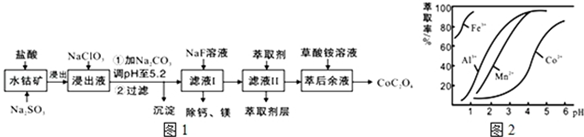
��֪���ٽ���Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Ca2+��Mg2+��Al3+�ȣ�
�ڲ���������������������ʽ����ʱ��Һ��pH���±���
| ������ | Fe��OH��3 | Fe��OH��2 | Co��OH��2 | Al��OH��3 | Mn��OH��2 |
| ��ȫ������pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
��2��NaClO3�������ǽ�����Һ�е�Fe2+������Fe3+����������Ԫ�ش�����ͻ��ϼۣ��÷�Ӧ�����ӷ���ʽΪClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O��
��3����ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ��ͼ2��ʾ����Һ���м�����ȡ���������dz�ȥ��Һ�е�Mn2+��ʹ����ȡ�����˵�pH��B��
A���ӽ�2.0 B���ӽ�3.0 C���ӽ�5.0
��4�������ơ�þ���ǽ���Һ��Ca2+��Mg2+ת��ΪMgF2��CaF2��������֪Ksp��MgF2��=7.35��10-11��Ksp��CaF2��=1.05��10-10�����������NaF��������Һ$\frac{c��M{g}^{2+}��}{c��C{a}^{2+}��}$=0.7��
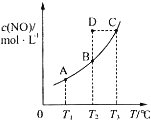 ���ݻ�һ�����ܱ������У�����һ������һ������������̼������ѧ��Ӧ��
���ݻ�һ�����ܱ������У�����һ������һ������������̼������ѧ��Ӧ��C��s��+2NO��g��?CO2��g��+N2��g��+Q��ƽ��ʱc ��NO�����¶�T�Ĺ�ϵ��ͼ��ʾ��������˵����ȷ���ǣ�������
| A�� | �÷�Ӧ��Q��0 | |
| B�� | ���÷�Ӧ��T1��T2ʱ��ƽ�ⳣ���ֱ�ΪK1��K2����K1��K2 | |
| C�� | ��T2ʱ������Ӧ��ϵ����״̬D�����ʱV����V�� | |
| D�� | ��״̬B��C��D��ѹǿ�ֱ�ΪPB��PC��PD���� PC=PD��PB |

 +NaHCO3
+NaHCO3
 +CO2��+H2O��
+CO2��+H2O�� ��
�� ��
�� �������
����д���� ��CH3CH2OHΪԭ�Ϻϳ�
��CH3CH2OHΪԭ�Ϻϳ� ��·������ͼ�����Լ�����ѡ�����ϳ�·������ͼ���£�
��·������ͼ�����Լ�����ѡ�����ϳ�·������ͼ���£�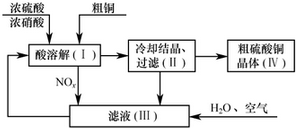
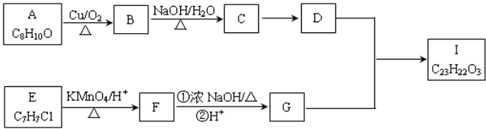
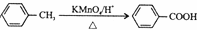
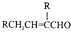
 ��
�� ��
�� ��
��